2. CONNAITRE LA PÂTE-TEMOIN, SI L’ON VEUT « CORRIGER »
2.1. La référence ; la dégradation enzymatique «native» de la farine.
Connaître mieux qui fait quoi dans la pâte.
Savoir le rôle de chaque intervenant qu'il soit composants naturels ou ajoutés est une qualification professionnelle.
Il nous faut aussi un point de référence. Ici c'est le parcours naturel d'une panification.
Le choix de l'auto-fermentation (fermentation au levain naturel) sera la base ou le témoin, auquel on se comparera. La fermentation alcoolique de la levure, dominante actuellement, sera vue puisqu'elle s'intègre de toute façon dans l'étude de l'auto-fermentation.
Ce sera à chacun de retirer de son savoir-faire et de sa compétence l'option d' «amendement» qu'il souhaiterait obtenir ou mieux respecter la vie naturelle d'une pâte comme le prescrit le décret tradition.
2.2. Les premieres enzymes actives ; les lipases.
La plante «blé» possède bien sur ses propres enzymes. Dans leurs fonctions premières (redonner un nouvel épi grâce à la semence) celles-ci dégraderont petit à petit les composants (lipides, glucides, protides et micronutriments) pour amorcer la vie dès que les conditions (chaleur et humidité ambiantes) seront en place.
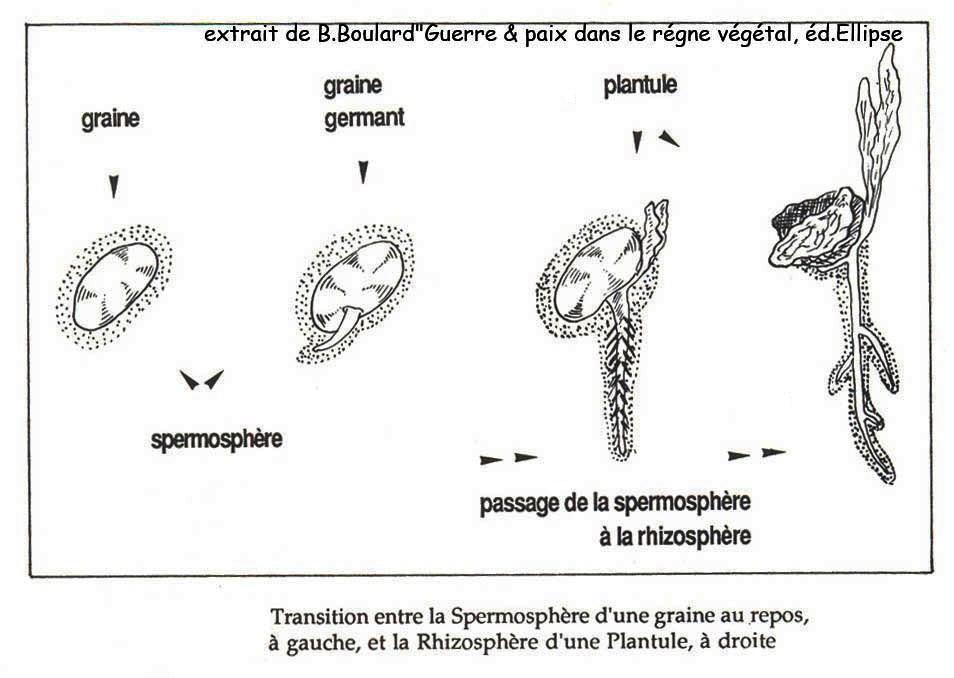
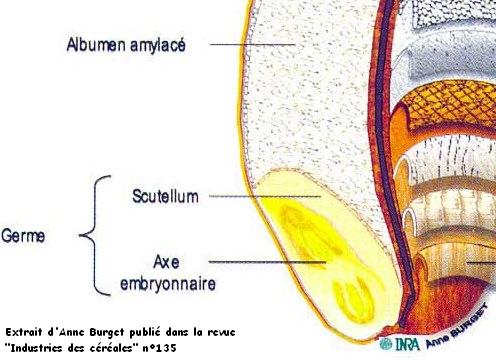
La dégradation démarre à partir du germe qui est l'endroit du grain le plus riche en nutriments vitalisant [1] et où se concentre la plus forte teneur en lipides [2]. C'est important de préciser ce point.
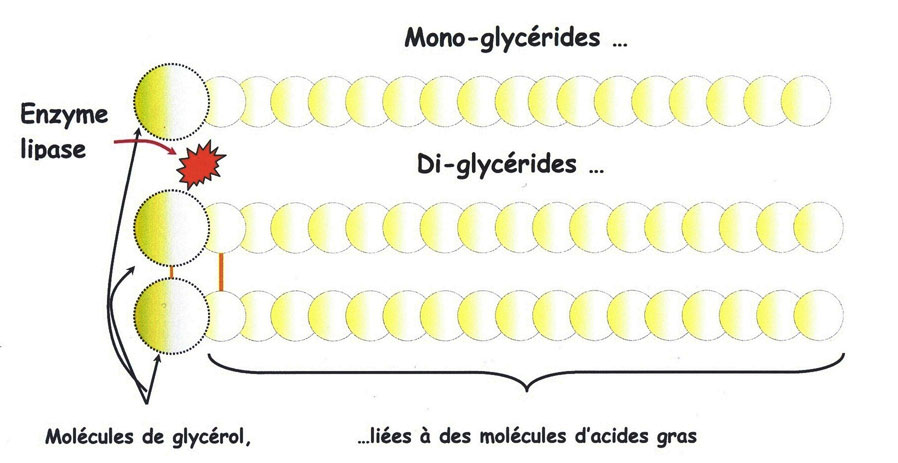
Les lipides sont en effet les matières du grain le plus facilement décomposables (ou plus précisément ici ; hydrolysables) [3].
Bien avant le mélange avec l'eau et le ferment au pétrissage, dès la simple conservation de la farine (particulièrement complète, comportant le germe), les lipases sont pratiquement les seules enzymes hydrolases en activité[4].
Où
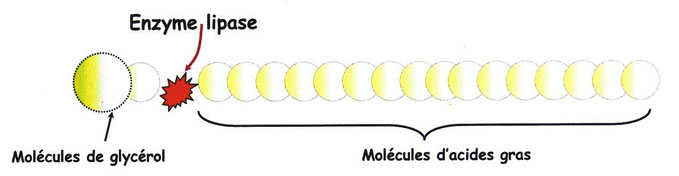
Afin d'avoir un repère simple de ce phénomène de dégradation (hydrolyse) enzymatique. Dans un premier temps (quelques semaines) on attribuera à l'action enclenchée par les lipases, le terme de maturation de la farine (appelé aussi «temps de plancher»)[5]. Après (quelques mois quand même), c'est l'odeur et le goût de graisse rance qui peut atteindre deux fois plus rapidement une farine complète qu'une farine blanche [6].
Au cours de la panification qui suivra (au pétrissage et dans la fermentation) l'activité des lipases sera plus faible [7].
D'autres réactions enzymatiques liées aux lipides, sont du le plus souvent à l'apport supplémentaires des corps gras ; soit par ajout de farine de légumineuses (fèves ou soja) plus riches en lipides, soit par ajout de matières grasses pour stabiliser la structure de la mie des pains «toasts» [8].
Ce cas de figure d'addition ne sera pas trop observé ici, puisque l'objectif de ce chapitre est de «lire» le positionnement naturel d'une farine. Mais comme les farines de légumineuses peuvent entrer dans le registre naturel et notamment dans la composition d'une farine de tradition, il est utile d'en dire un mot.[9]
Dans le cas de figure de pétrissage intensif, l'«amélioration» que devrait apporter une farine de légumineuses (fèves ou soja) contenant des lipoxygénases, s'est avéré ne pas être le choix le plus judicieux pour un aspect important, le goût. [10]
2.3. Les seconds enzymes «natives» actives ; les amylases & protéases
Voilà pour les lipides. S'ensuit lors du pétrissage et de la fermentation, la dégradation des glucides et protides. Les premiers abordés sont aussi ceux qui sont les plus accessibles, tant au niveau de leurs situations dans la graine (en périphérie près du germe, notamment la couche d'aleurone), qu'au niveau de leur faculté à être plus vite bio-assimilable (parce que contenant de plus grandes quantités de sucres simples [11] et protéines solubles [12]).
Tout est naturellement bien en place pour que la vie puisse se «starter».
Après la partie germe, c'est le cœur du grain (l'albumen devenant farine blanche où encore, amidon) qui sera consommée, un peu comme une réserve d'aliment, pour continuer la germination[13].
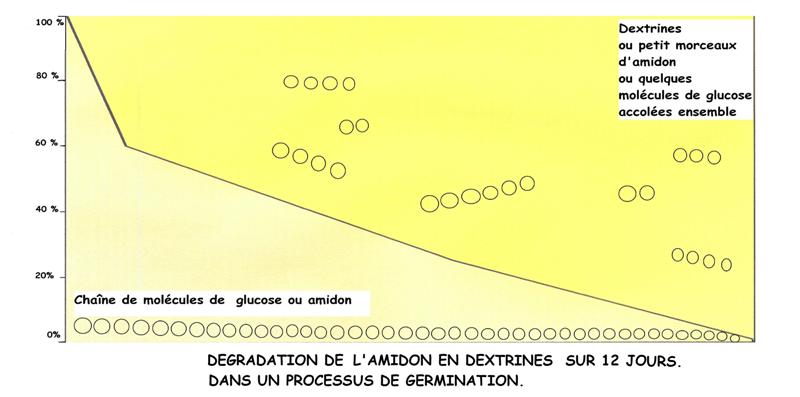
Après le pétrissage, avec l'apport d'eau et de ferments, la fermentation panaire, activée par ses microorganismes, a une dégradation nettement plus rapide que la germination[14]. C'est un constat clair dans les premières heures de la fermentation.
Ces premiers temps d'ensemencement microbien de la pâte, ce seront les levures et bactéries qui consommeront les sucres directement fermentescibles qui ne font que 1% du «substrat farine» [15].
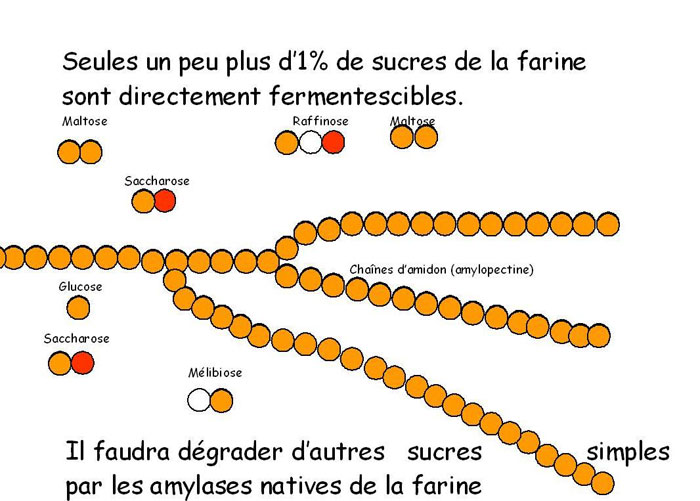
Ces sucres sont dits «simples», mais c'est comme souvent dans ce dossier, pour… simplifié, qu'on les appelle ainsi. Si l'on veut approfondir, il faut préciser que le sucre le plus simple est celui qui ne compte qu'une molécule (le plus souvent en panification, le glucose). Lorsqu'il est composé de deux molécules, il sera encore nécessaire de les scinder en deux molécules distinctes.
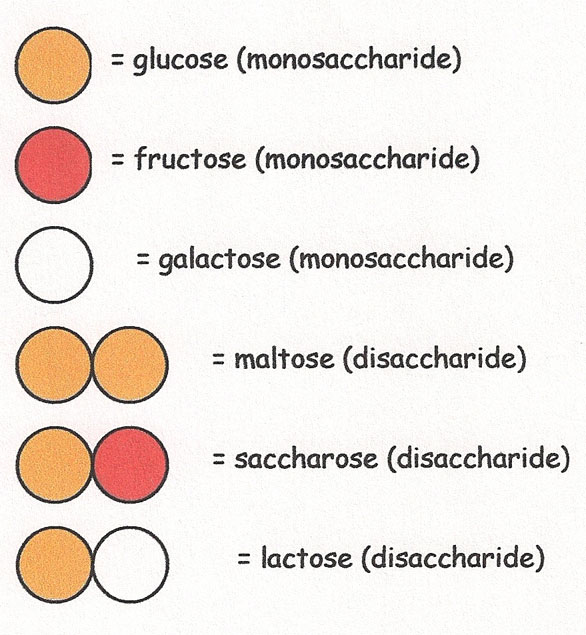
2.3.2. Les enzymes qui séparent deux molécules liées entre-elles
Pour le sucre «simple» maltose, l'enzyme maltase va séparer les deux molécules de glucose accolées entre-elles, pour procurer 2 molécules de glucose.
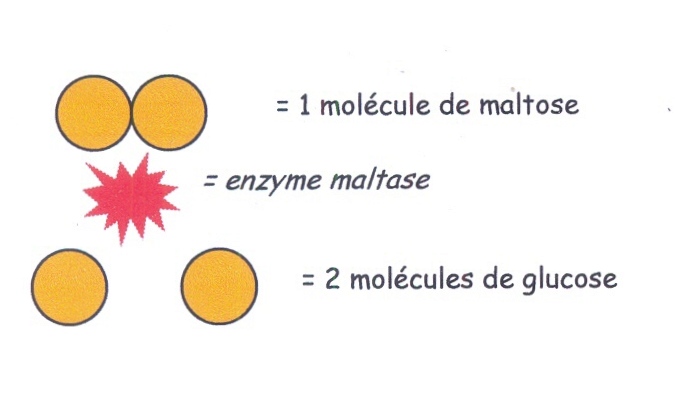
Rappelons qu'au niveau du goût, le maltose et le glucose ne son pas repéré de manière identique comme nous l'avons vu au chapitre 1.4. Il est probablement assez important de faire profiter la pâte d'une bonne transformation de l'amidon en maltose lors de la fermentation, dans une recherche de goût[16].
Autre enzyme très tôt repérée[17], la saccharase. Le saccharose n'étant présent que dans les sucres « simples », l'enzyme le décomposant (la saccharase) ne sera importante que lors des premières heures et lors d'une panification avec ajout de sucres (généralement du saccharose). Elle va séparer les deux molécules soudées (une molécule de glucose accolée à une de fructose) pour procurer ces deux molécules séparées.

La dégradation de ces deux di-saccharides se réalise dans l'espace entre les deux membranes de la paroi cellulaire [18].
Ce passage de la description de la saccharase nous permet d'introduire une notion de biochimie en plus sur un pouvoir rotatoire de molécules. Soit vers la gauche (levogyre ou L) ou vers la droite (dextrogyre ou D).
Le phénomène qui apporte l'expression «sucre inverti» et «invertase» est le fait que le saccharose fait tourner la lumière [19] vers la droite, alors que le mélange des deux molécules séparées fait tourner la lumière vers la gauche. Une inversion de la polarisation de la lumière s'est réalisé, d'où les dénominations précitées pour le mélange des deux molécules et l'enzyme.
2.3.3. Tous ces «sucres simples» s'assimilent différement, par tous les divers microorganismes du levain.
La fermentation panaire au levain naturel va pouvoir disposer de ces diverses molécules de «sucres» (maltose, saccharose, fructose, glucose). La diversité des «sucres» de la farine vous est mieux connue, mais il existe aussi une diversité de microorganismes dans la fermentation de la pâte au levain. En effet, telle ou telle souche de levures ou de bactéries ont des facultés d'assimiler le maltose d'autres pas. Dans la fermentation au levain naturel, cela peut donner l'occasion de concurrence ou compétition entre microorganismes pour leur nourriture de «sucres» disponibles dans le « substrat » farine. Dans le meilleur des cas une complémentarité s'installe lorsque l'un fermente le glucose et l'autre le maltose.
Dans la fermentation ensemencée à la levure de panification, la situation est plus simple, d'autant que la souche «saccharomyces cerevisae» est une des rares souche de levure qui peut assimiler autant le glucose que le maltose (le deux sucres les plus présents), ce qui n'est pas une propriété de toutes les espèces de levures «sauvages» présentes dans une fermentation ensemencée au levain naturel [20].
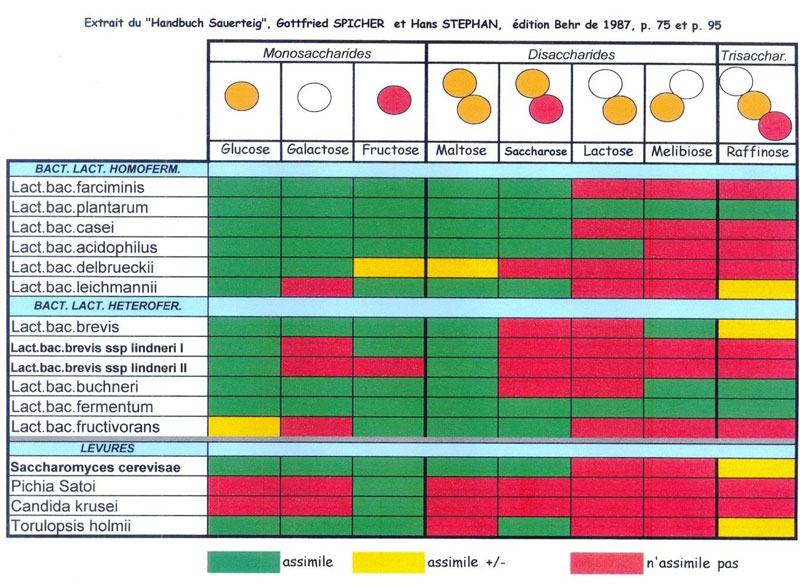
Dans le tableau suivant[21], datant déjà de quelques années, vous pourrez remarquer les facultés fermentaires sur les différents sucres de quelques microorganismes recensés au sein des levains naturels en Allemagne.
On y remarque que les autres levures du levain (à part la Saccharomyces Cerevisae) n'assimile pas les sucres dissacharides (ou mieux diholosides = de 2 molécules).
Les bactéries lactiques semblent mieux transférer le maltose pour l'assimiler. Ce serait peut-être du à une meilleure perméabilité de leurs parois cellulaires[22].
2.3.4. Après les sucres simples; la «trop ?» lente découpe de l'amidon.
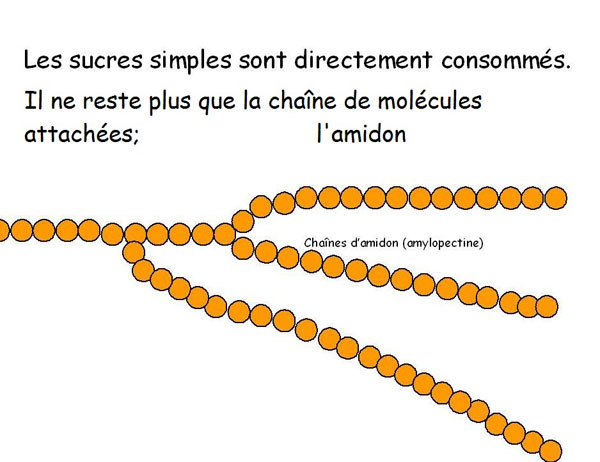
Lorsque la consommation de ce petit pourcentage de sucres «simples» sera achevée, elle ne saura reprendre qu'après découpage ou dégradation de ces longs bouts de chaînes d'amidon où les molécules de glucose sont accolées les unes aux autres.
Les microorganismes devront attendre que les enzymes de la farine cisaillent l'amidon, afin de procurer des mono-, di- ou tri-saccharides que les microorganismes pourront eux aussi dégrader.
Michel Berger donne, début des années 1980 une belle description de l'évolution des sucres de la farine au cours de la fermentation[23].
Le progrès que l'on suivait comme objectif concernant la fermentation panaire était d'aller toujours plus vite, aucune autre considération que la vitesse d'exécution. A cette époque (les sixties-folies ou années soixantes) la prise en compte de la fermentation comme un espace goût n'entrait pas en ligne de compte comme objectif[24].
Les boulangers d'alors observaient facilement avant les années 1970, (c'est-à-dire, avant la génération des levures dites «rapides»[25]), une stagnation de la fermentation après 1 heure. Celle-ci reprenait après ½ heure, comme le décrit le schéma ci-après.
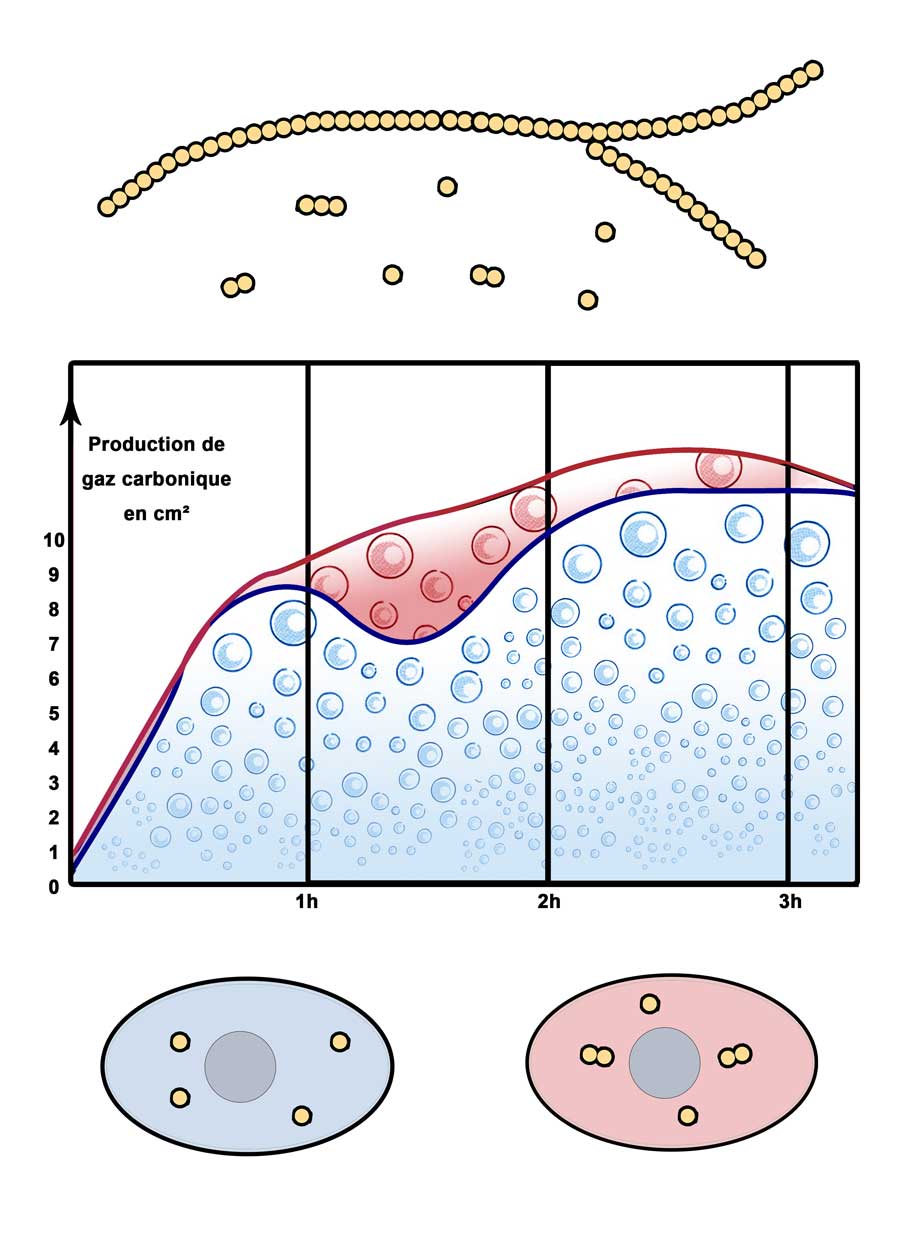
En rouge, sur ce schéma, le dégagement gazeux après les années 1970 et les levures «rapides».
En bleu, le dégagement gazeux avant les années 1970 et les levures n'ayant pas encore la faculté, apportée grâce à la sélection des souches en levurerie industrielle, d'assimiler plus vite le maltose [26].
2.3.5. Carte d'identité des deux amylases «natives» ; l'alpha et la bêta.
Pour dégrader la «réserve» de sucres de l'amidon, le grain compte sur les amylases natives du blé. Si l'on demande «leurs papiers» aux amylases natives du blé, on a deux types d'amylases natives ; l'αlpha amylase [27] et la βêta amylase.
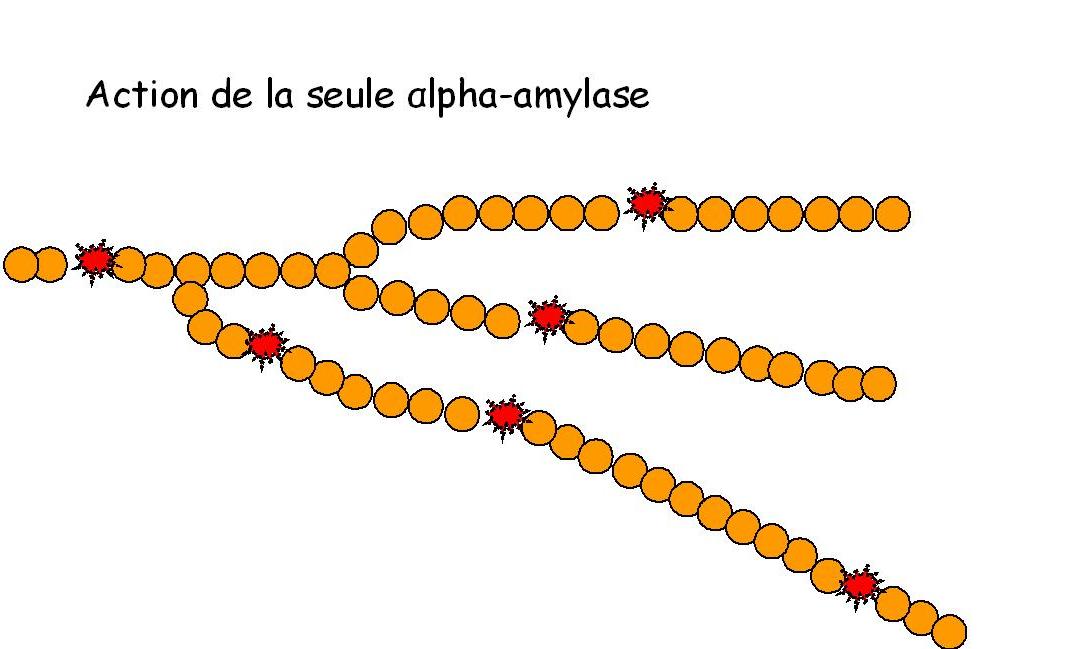
L'alpha amylase (ou α-amylase) est dite endo-enzyme parce que son action de dégradation de l'amidon se déroule en plein milieu (à l'intérieur) de la chaîne.
La bêta amylase (ou β-amylase) est elle dite exo-enzyme, puisque son action de dégradation ne peut se réaliser qu'en démarrant d'une extrémité de la chaîne d'amidon et en dégradant par paire de molécules de glucose (= maltose).
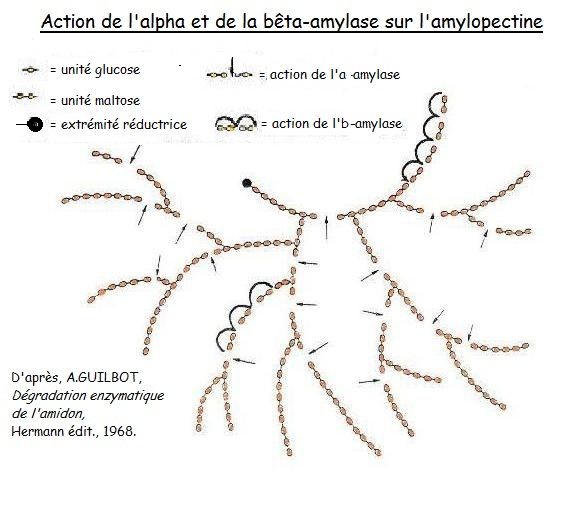
Cette distinction endo/exo-enzyme est précieuse pour comprendre la complémentarité entre ces deux fonctions de dégradation enzymatique.
Cette dégradation provoque une diminution de la viscosité (d'où l'action est dite parfois «liquéfiante») et dans le cas de la dégradation de l'amylose donne en résultante principalement du maltose et du maltotriose [28].
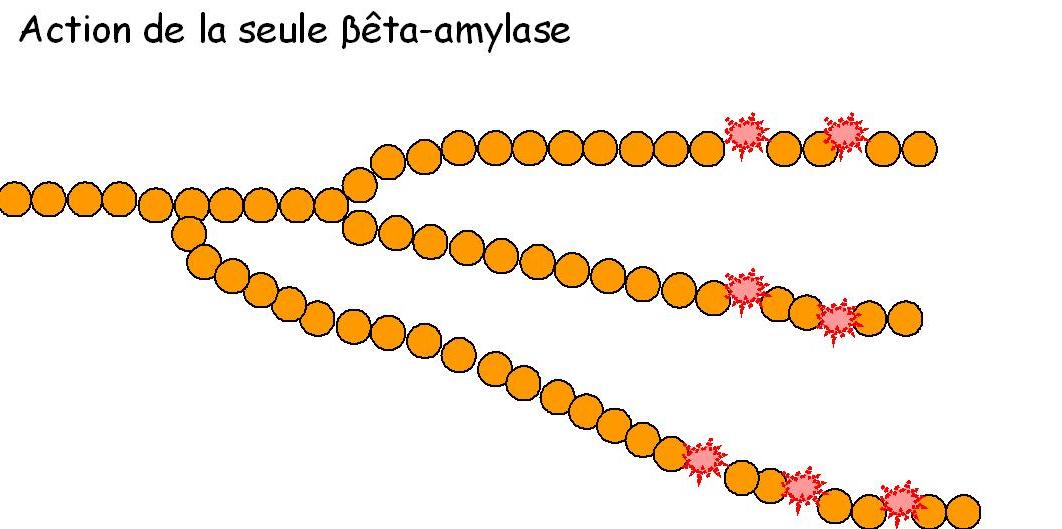
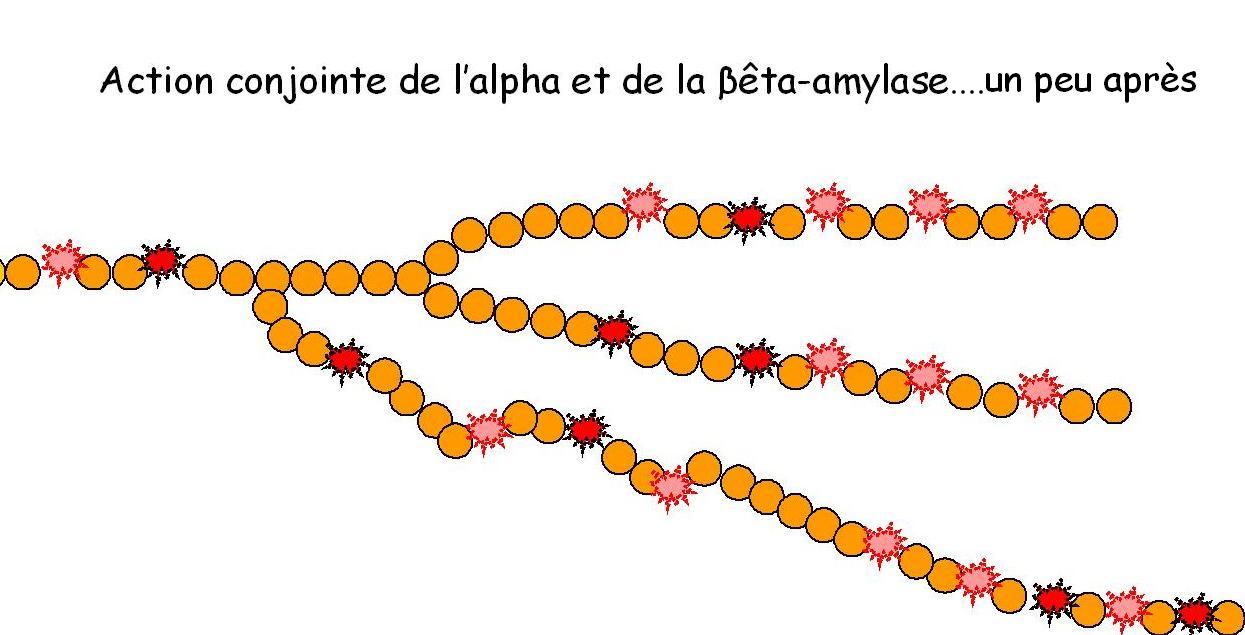
Pendant que l'α-amylase coupe des bouts d'amidon, la β-amylase rend ses bouts d'amidon disponibles en les réduisant en maltose (2 molécules de glucose soudées entre-elles) disponible dès lors pour la levure de boulangerie ou la bactérie lactique.
2.3.6. L'importance de l'action conjointe des alpha et bêta-amylases.
Suit l'importance d'un équilibre entre l'action «dextrinisante» [29] de l'α-amylase et l'action «saccharifiante» [30] de la β-amylase.
En effet l'aboutissement d'une action de la seule α-amylase donnera au sein d'une pâte, un aspect apuré et suintant que l'on retrouve lors de l'emploi de farine hyperdiastasique (voir chapitre 1.7.), puisque la β-amylase n'évolue pas en teneur lors de la germination [31].
Voilà pourquoi cet équilibre est conséquent pour la qualité de la pâte et du pain [32]


2.3.7. La dégradation du glucose par les microorganismes de la fermentation au levain naturel.
Lorsqu'on en arrive à avoir réussi à dégrader l'amidon et mis à disposition de nouveaux sucres «simples», on revient vers la fermentation de ceux-ci déjà entrevue aux chapitres précédents (chap. 2.3.2. à 2.3.6.). Le «carburant» de la fermentation panaire est de nouveau disponible, mais maintenant, on sort du système enzymatique de la farine et entre dans le système enzymatique des microorganimes.
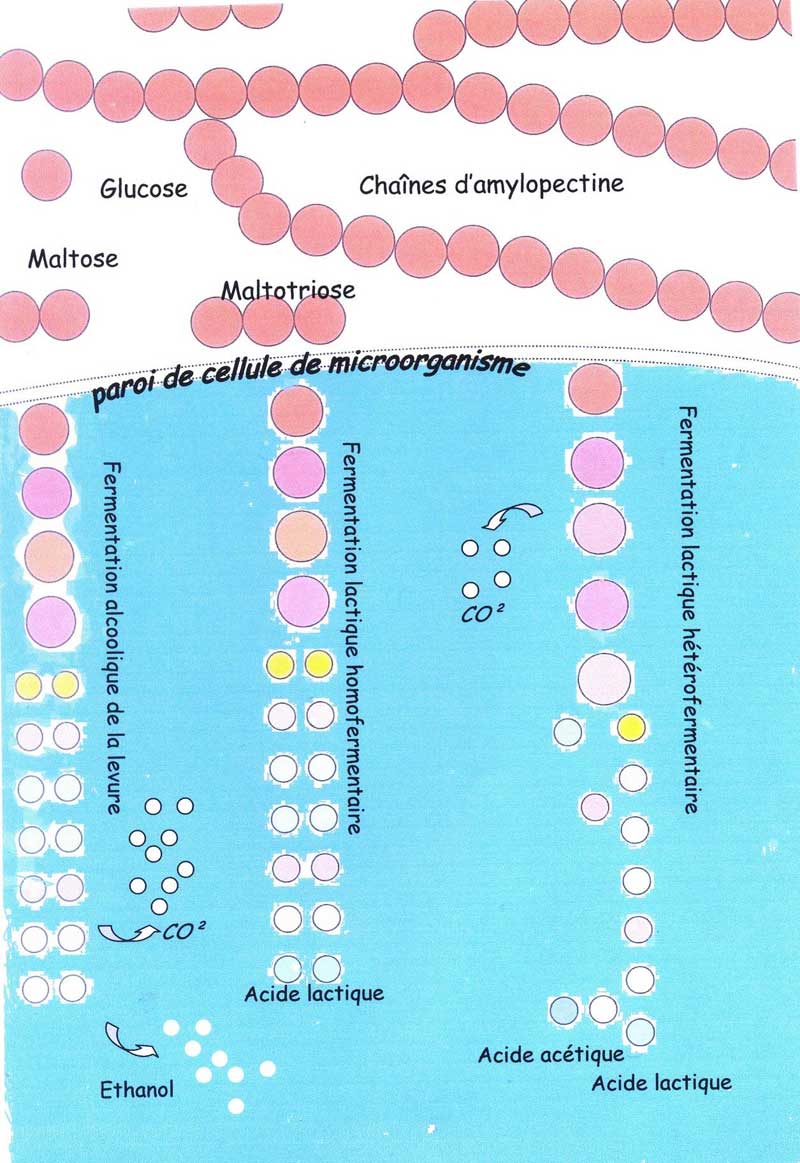
Le choix de notre approche de la fermentation - témoin étant celle du levain naturel, c'est une fermentation qui est biodiversifiée (trois voies fermentaires différentes).
Chaque voie pourrait porter le nom de cascade enzymatique. L'enzyme en tête de cette cascade de dégradation, une fois sa mission réussie, va permettre à l'enzyme suivante d'œuvrer et ainsi de suite en démultipliant les actions.
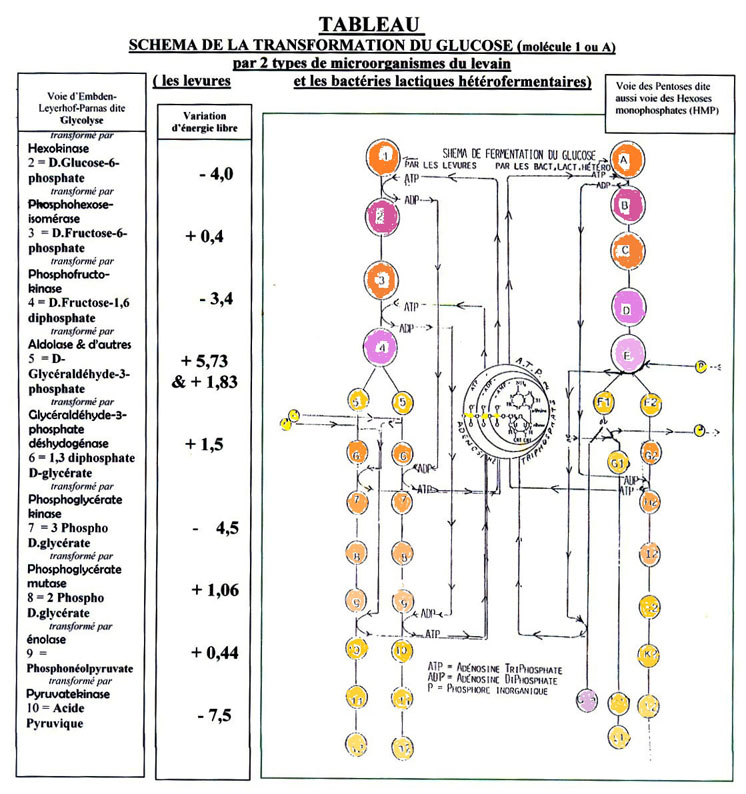
Les trois voies fermentaires des trois types de microorganismes du levain empruntent soit des bouts de chemins, soit toute, la transformation de la molécule de glucose en acide pyruvique, qui s'intitule la glycolyse (nom qui vient du grec, et signifie ; scission ou dissolution du sucre).
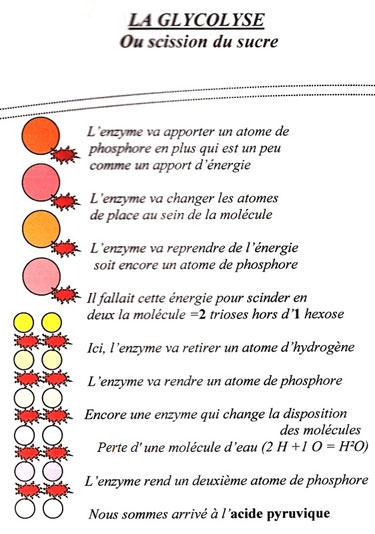
Nous allons voir cela de manière récapitulative en donnant une version épurée des appellations scientifiques (et aussi grâce aux diaporamas annexés qui synthétisent encore plus facilement certaines phases).
Il faut bien savoir qu'à partir de la dégradation des sucres «simples», tout se passe à l'intérieur du microorganisme et que toute modification ou «amélioration» que l'on voudrait apporter est du domaine de la microbiologie, ce n'est plus dans la farine que s'aménage les modifications. On ne parle plus d'ajout d'enzymes au sein du substrat farine, mais d'amélioration ou modification de la souche de levures (généralement) ou de bactéries lactiques.
Le levain est une fermentation mixte, c'est-à-dire qu'il est à la fois une fermentation alcoolique et une fermentation lactique. D'accord, deux types de fermentation, mais pourquoi trois voies fermentaires. En fait, c'est la fermentation lactique qui se subdivise en deux voies différentes.
2.3.8. La voie lactique homofermentaire
Pour la version simplifiée, on a une version de fermentation lactique qui ne produit, à la fin de la dégradation de la molécule de glucose, que de l'acide lactique.
La bactérie lactique sera dite pour cette raison «homofermentaire» puisqu'un seul type d'acide sera la résultante de ce type de fermentation du glucose.
FERMENTATION LACTIQUE HOMOFERMENTAIRE
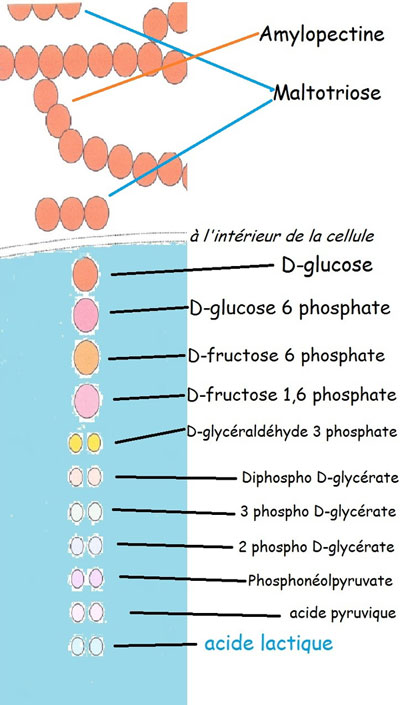
Une molécule de glucose donne au final deux molécules d'acide lactique.
Entre le glucose et l'acide lactique, neuf molécules différentes sont issues de dix transformations enzymatiques.[33]
2.3.9. La voie lactique hétérofermentaire
«Hétéro-» puisque la voie fermentaire au final a non seulement produit de l'acide lactique mais aussi de l'acide acétique, du gaz carbonique et de l'alcool.
Quatre métabolites terminaux pour cette voie la plus complexe, dite des pentoses, puisque à un moment de la dégradation de la molécule de glucose, il va perdre un atome de carbone associé à deux atomes d'oxygène, soit du CO² ou gaz carbonique. Plus loin, une molécule aboutira en acide lactique et l'autre en acide acétique[34].
FERMENTATION LACTIQUE HETEROFERMENTAIRE
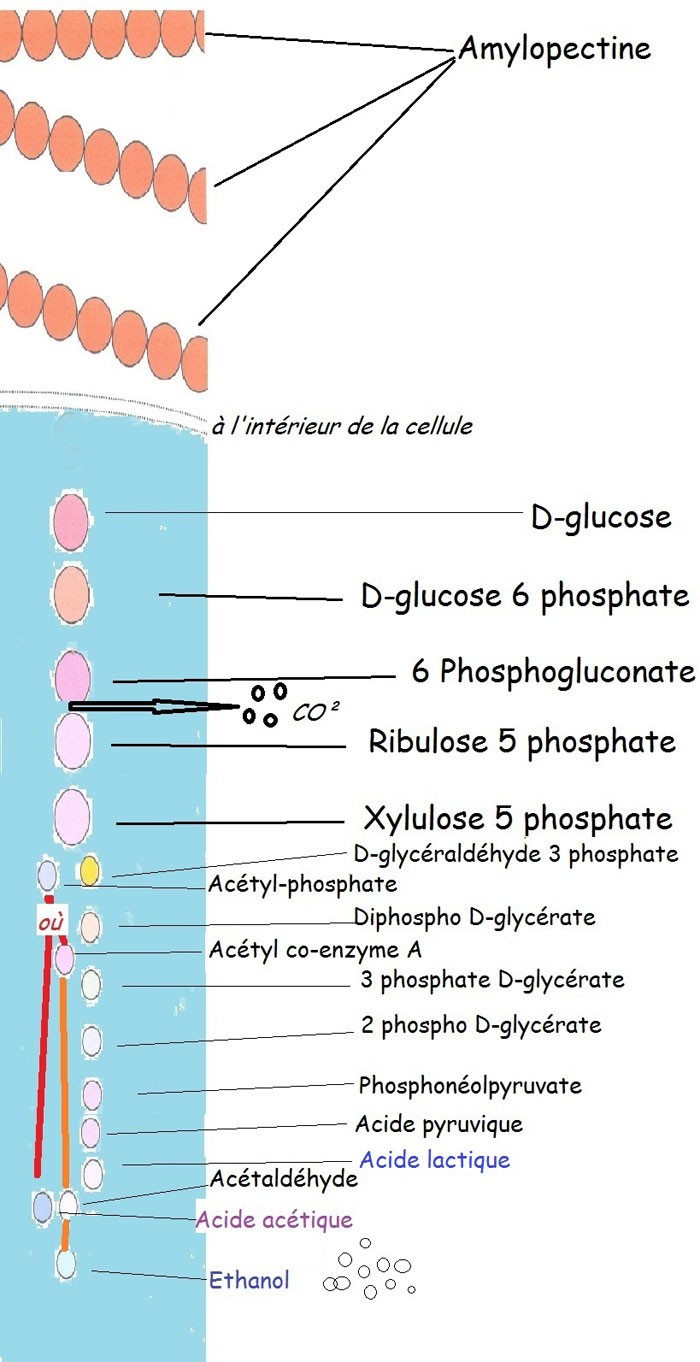
Inventaire chiffré de cette voie très «hétéro», une quinzaine de molécules différentes avec de l'acide lactique (50%), de l'acide acétique (50%) et aussi un dégagement de gaz carbonique. Au travail, une douzaine d'enzymes différentes au moins (puisque un choix se propose après l'acétyl-phosphate) qui donnera soit de l'éthanol (alcool), soit de l'acide acétique, cette dernière semble bien la plus repérée.
2.3.10. La fermentation alcoolique des levures.
La fermentation alcoolique est la plus connue des boulangers, c'est pratiquement une question d'examen de fin de CAP. Elle produit «les yeux du pain» disaient les anciens, le gaz carbonique ou CO² qui emprisonné par le réseau glutineux aère la mie du pain.
Au final, de sa dégradation de la molécule de glucose, de l'alcool qui à la cuisson s'évanoui dans l'air, mais embaume les boutiques de boulangerie, est la fameuse odeur du pain frais.
FERMENTATION ALCOOLIQUE
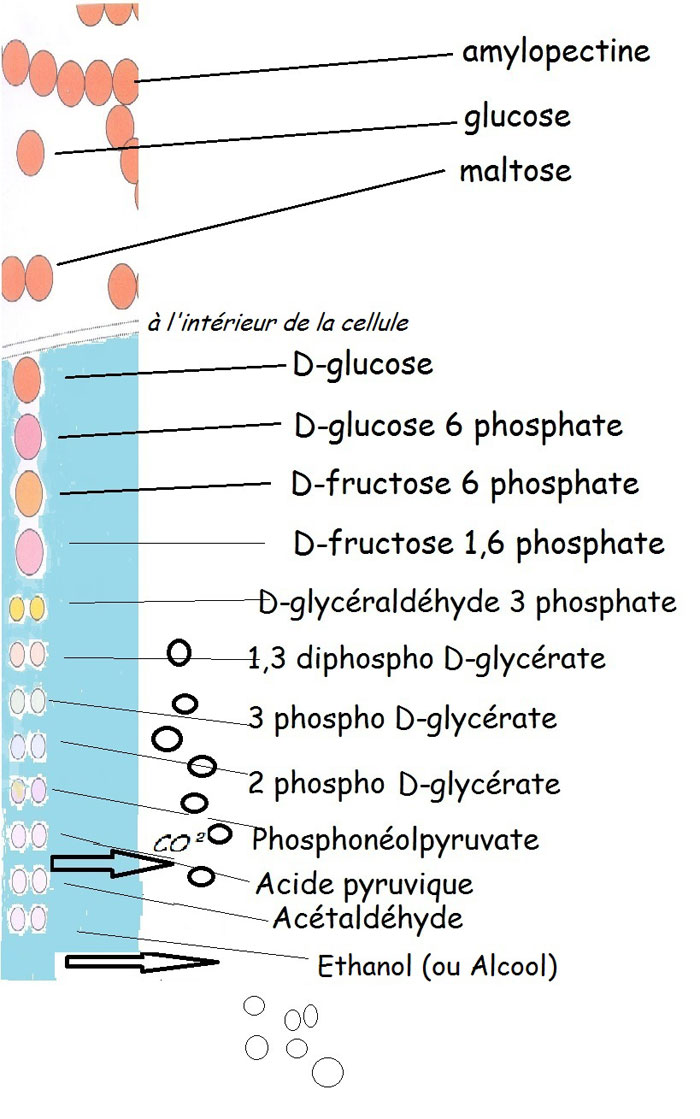
2.3.11. Les fermentations secondaires.
S'il existe des métabolites terminaux (gaz carbonique, éthanol, acide lactique et acide acétique), les molécules intermédiaires (aldéhyde, glycérate, par ex.) sont très volatiles et aromatisantes également. Ce qui me gâte rien au niveau de la recherche du goût évidemment.
Il existe aussi des fermentations dites secondaires dans les fermentations levurées, celles-ci sont estimées à ± 5% en produisant glycérol, acides organiques, aldéhydes, esters, alcools supérieurs [35]
Dans la fermentation au levain, on compte aussi, mais presque à l'état de traces (0,59% de l'acidité titrable), d'autres acides organiques (propionique, isovalérique, valérique, isobutyrique, butyrique) [36], dont certains (les «iso») sont plus présent dans la fermentation ensemencée à la levure, mais dans ce dernier type de fermentation, cette fermentation secondaire n'est pas masquée par ce que celle-ci procure d'acide lactique et d'acide acétique, nettement plus importante, multiplié des milliers de fois dans la fermentation au levain par rapport à la fermentation levure.
Toujours dans la fermentation au levain, il existe aussi de la part des bactéries lactiques des fermentations dites secondaires dégradant des acides organiques (malique, fumarique et citrique) et aboutissant à des formations d'acide pyruvique [37]
RECAPITULATIF DES FERMENTATIONS ALCOOLIQUE & LACTIQUES DU GLUCOSE
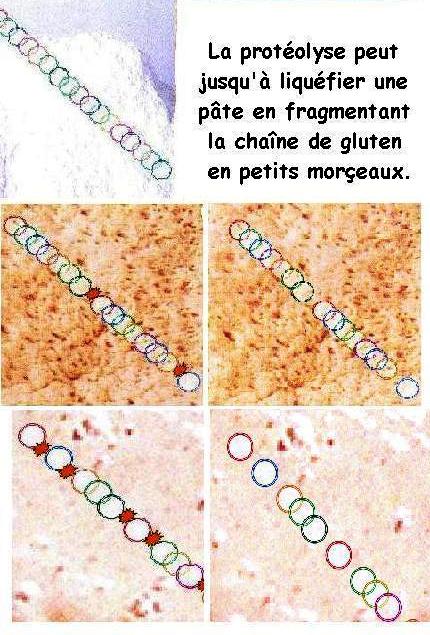
2.4. Les protéases
2.4.1. La protéase native, parfois ; «un pont trop loin».
Probablement plus que la dégradation excessive de l'amidon, la crainte du boulanger est cette déstructuration des protéines et notamment du gluten, cette partie de la farine qui rend la pâte élastique. Pas envie de livrer le pain par en dessous de la porte, le boulanger. Une appréhension qui tourne à angoisse lorsqu'on en arrive à produire de la «savate» comme le décrit Emile Dufour [38]. Ou abouti à cette autre appréciation des hommes de métier, un état dit de «pourrissement» de la pâte, du à un excédent de fermentation[39]. Tout est question de bonne conduite de la fermentation panaire qui doit s'adapter quotidiennement à des situations fluctuantes (météo, changement de farine, par exemple). Une vigilance fine dans le suivi des paramètres ajusté par l'expression professionnel.
Cette dégradation de la pâte sera enclenchée et poursuivie d'autant plus rapidement si la récolte de l'année a subi une germination sur pied ou dans le cas plus rare, qu'elle ai subi une introduction d'activité protéolytique du à des insectes («blés punaisés», par exemple) [40] ou de moisissures.
La découpe des protéines en peptides et surtout acides aminés est un bénéfice nutritionnel, de par la meilleure bio-assimilation apportée Ce qui résulte de la fragmentation des chaînes de protéines qui s'opère de toute façon en digestion.
Certaines bactéries lactiques du levain apportent une dégradation des protéines et peptides qui augmente la teneur en acides aminés, comme le montre ce tableau réalisé en 1983 par un microbiologiste allemand spécialiste du levain ; G.Spicher.

Mais technologiquement et comme dit d'entrée de jeu dans ce chapitre des protéases natives, le boulanger ne peut poursuivre une dégradation jusqu'à déliter (désagréger) une pâte.
2.4.2. L'apport aromatique de la dégradation des protéines.
L'apport gustatif et aromatique de la protéolyse, qu'on appellera «ménagée», est également bien reconnu par les anciens manuels de boulangerie et confirmé par des écrits récents plus approfondi[41].
Certains acides aminés (lysine) iront former la croûte en se «soudant» avec des sucres [42]. Dans la fermentation au levain plus que dans la fermentation avec la seule levure, d'autres acides aminés, (proline, leucine, arginine, isoleucine, phénylalaline & méthionine) peuvent jusqu'à se désaminés (perdre leur atome d'azote) et aboutir en substances volatiles donnant arômes et goût à la mie[43]. La réputation des protéines en apports aromatiques n'est plus à démontrer dans l'alimentaire. Le très connu exhausteur de goût, le glutamate, dérive de l'acide aminé ; l'acide glutamique[44].

Ces arômes de «jus de viandes rôties» qui s'élaborent souvent avec la cuisson, ont fait notamment la renommée gastronomique des sauces concentrées en cubes de bouillon.

Dans la cuisine asiatique, les sauces de soja et sauces de poisson, s'obtiennent avec le procédé de l'hydrolyse non plus «ménagée» mais assez «poussée» des protéines (un à deux ans de maturation pour la sauce de poisson).

2.4.3 Attention toutefois aux peptides amers.
Au niveau du goût, la protéolyse peut conduire à des aspects moins positifs lors d'une trop longue maturation de la pâte, la dégradation des protéines peut présenter le développement de peptides amers [45]. Une amertume présente parfois dans les fermentations panaires poussées trop loin[46] et sans soin où au contrôle non régulé dans la longueur de sa durée par une température au froid positif.

Situation plus rare, certaines bactéries déclarées de «polluantes» dans la microflore du levain, produisent aussi un goût amer [47]. Cela peut exister dans la fermentation au levain ayant vécu de hautes températures, ensemencé d'un levain-chef dont la microflore a épuisé le substrat ou un levain-chef en formation, trop jeune et n'ayant pas encore réalisé, par des rafraîchis successifs, l'épuration des bacilles coliformes par l'obtention d'une acidification prononcée.[48]
2.4.5. Pas que de la dégradation, mais aussi assemblage, pontage et liaisons.
Tout n'est pas que protéolyse (le chemin vers le pourrissement ou d'hydrolyse). Il existe d'autres possibilités de transformations que la découpe en plus petits éléments des protéines. Et cela est intéressant technologiquement.
Enzymatiquement, on peut aussi changer les structures et les fonctions des protéines. Sont possibles, des réactions de pontage ou greffage entre protéines, en quelque sorte une liaison en réseau. Ce qui n'est pas le cas pour les «sucres» ou glucides de l'amidon de la farine.[49]
Ce qui se vit dans le fournil notamment après un temps de pause (au pointage ou fermentation de la pâte après pétrissage) par un geste plus artisanal qu'industriel, le rabat de la pâte. On y remarque de suite qu'après un simple repliage de la pâte sur elle-même on redonne une cohésion, un «corps», à la pâte que celle-ci avait perdue lors d'un court temps de fermentation.

Ce vécu que l'on ressent facilement dans les mains est une preuve vivante que les protéines sont des chaînes d'acides aminés promptes à rétablir des liaisons entre-elles, alors que dans la phase précédent ce «resserement», la pâte était plus lâche [50].
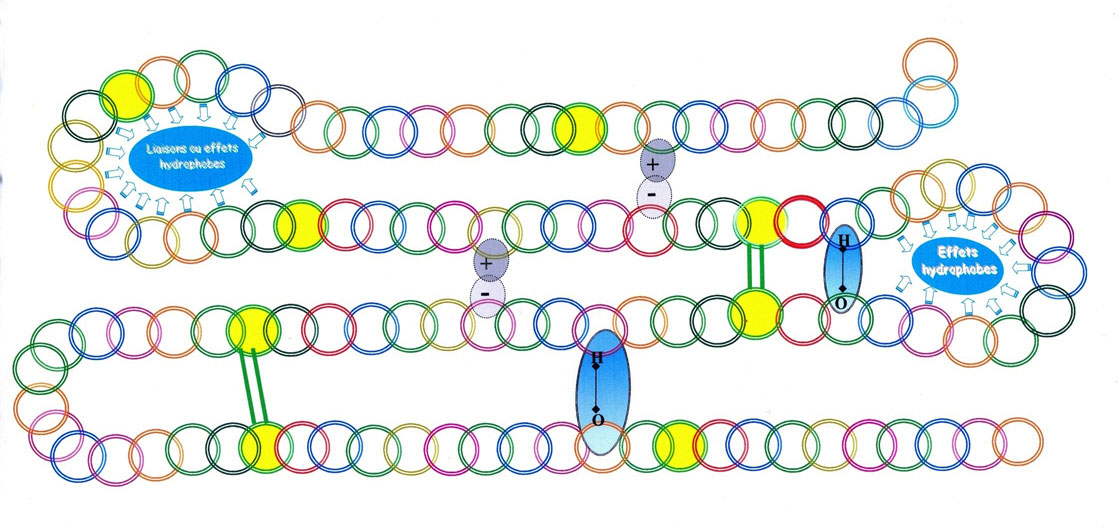
2.4.6. Les diverses possibilités de liaisons
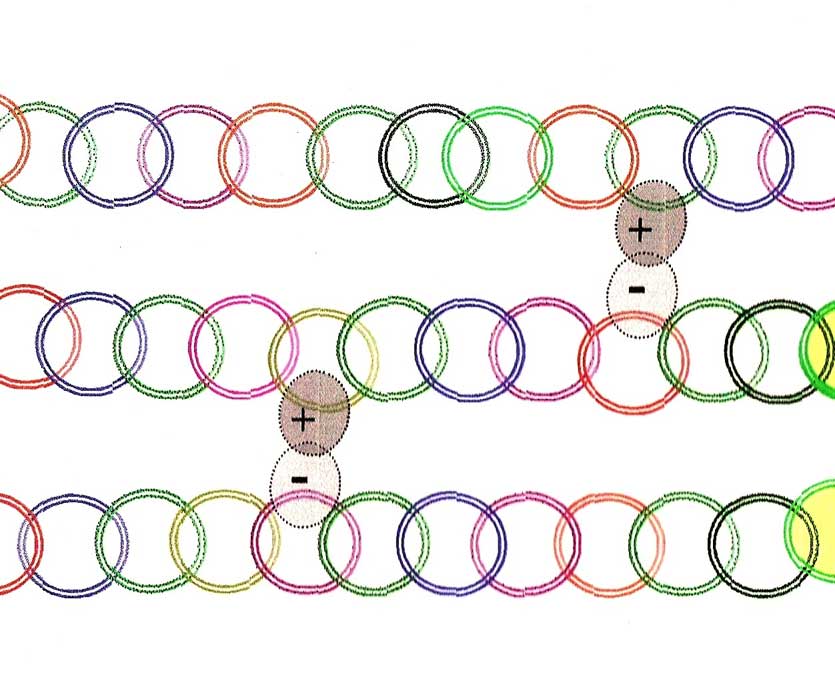
Dans les acides aminés , il y a ceux qui aiment l'eau (hydrophyles [51]), ceux qui repoussent l'eau (hydrophobes[52]) et qui en se rapprochant entre eux, changent souvent les ordres ou positions au sein de la chaîne de protéines.

Les molécules (ici les acides aminés) peuvent être chargées d'ions comme de l'électricité portée par un corps. La charge est soit négative (-) soit positive (+).
Il existe même sur le marché d'appareils ioniseurs d'air apportant les ions négatifs pseudo - bienfaiteurs pour la santé [53].
Entre ces deux ions ( + & -) peut se créer un autre type de liaisons; les liaisons ioniques[54]
Les liaisons phénoliques (où liaisons hydrogènes), présentes en quantité limitée dans une farine, elles, vont prendre de plus en plus d'importance dans l'approche d'ajout d'enzymes dans une pâte de farine de froment, en remplacement de ce qu'on demandait à des agents additifs oxydo-réducteurs (bromate et acide ascorbique).
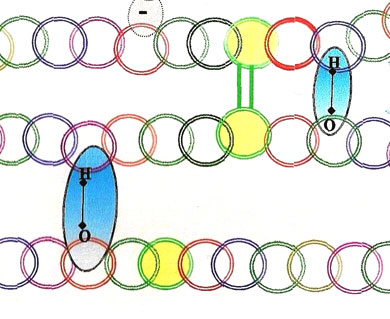
Dans les plus fortes liaisons, du moins les mieux repérées par les études de technologies boulangères, celles qui s'établissent (après oxydation) [55] entre deux atomes de souffre, appelées ; les ponts disulfurés.
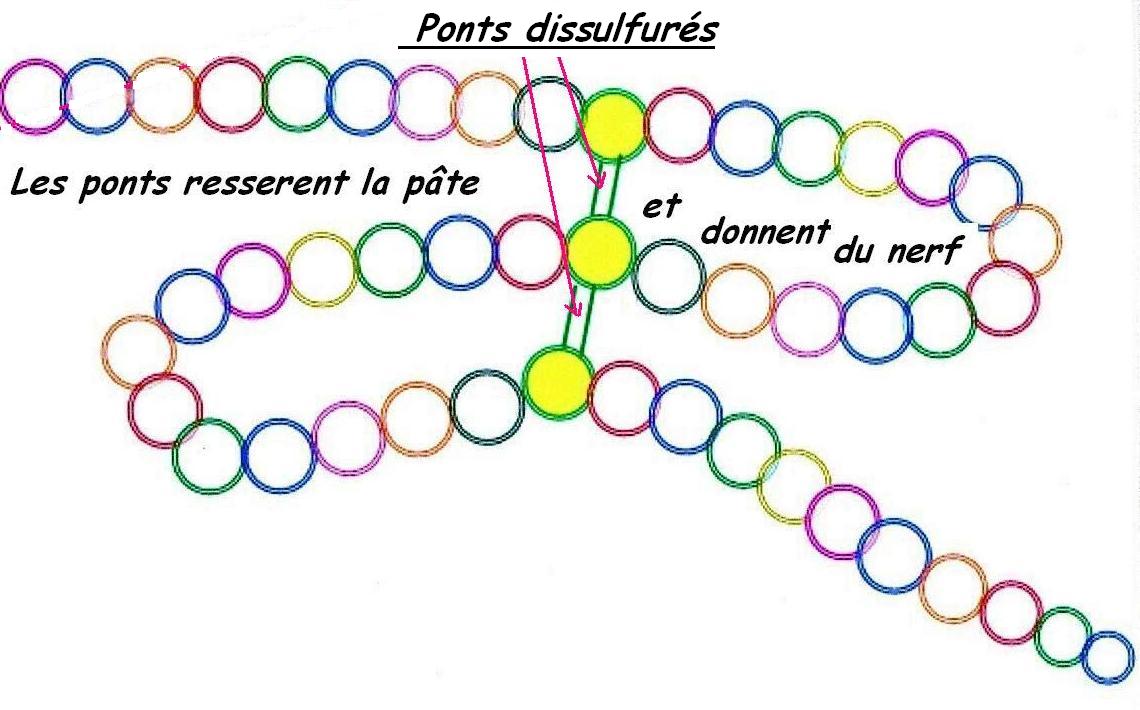
On le voit, avec les apports du mouvement de ce milieu aqueux qu'est la pâte, tout est en place pour se lier et se délier au niveau des chaînes (ou réseaux) protéiques.
Les diverses liaisons réalisées entre les protéines pour créer de nouvelles structures
2.4.7. La trop longue protéolyse dans les pâtes ensemencée à la levure
Les levures sont moins aptes que les bactéries à dégrader les protéines, elles secrètent cependant des protéases.[56] Une fermentation de la pâte ensemencée à la levure poussée trop loin en durée [57], arrive à être un milieu où des cellules de levures dépérissent. Ces levures mortes aux parois cellulaires désagrégées apportent leurs contenus qui seront un apport nutritif de premier choix [58] . Avant cette cytolyse (destruction de la cellule), certains peptides sont confinés au sein de la cellule de levure, citons un des plus repéré qui porte le nom de glutathion.
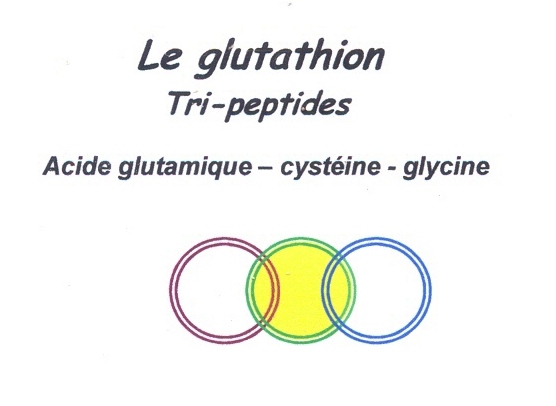
Celui-ci était alors sans effet, puisque captif de la cellule auparavant, devient disponible dans la pâte.
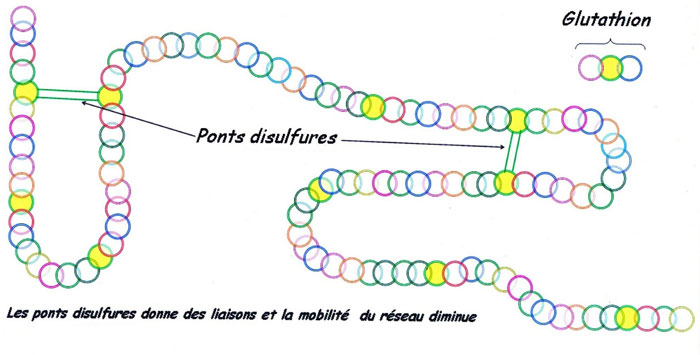
Les ponts disulfures avant (en-haut) et après (en-bas) l'action des levures désactivées contenant du glutathion.
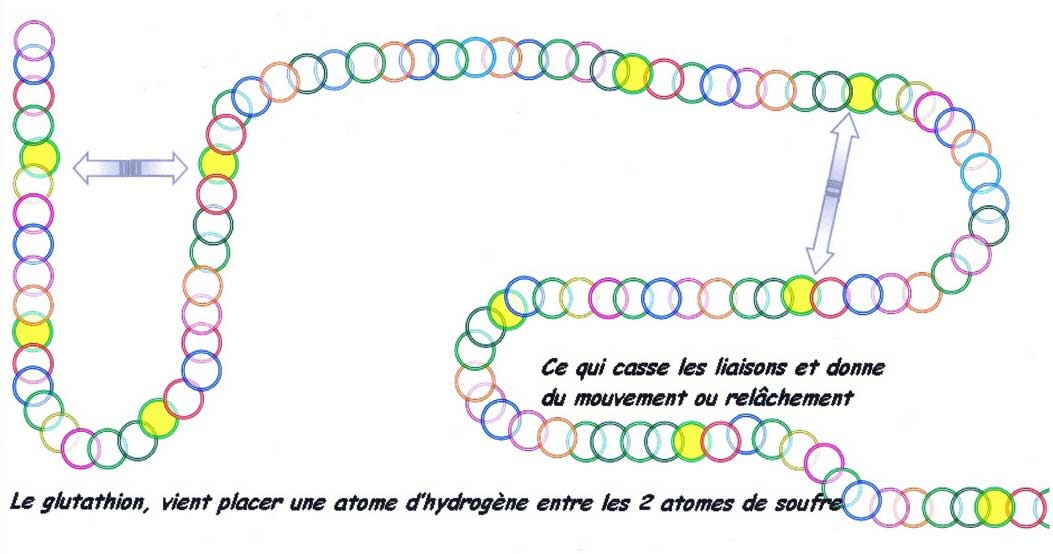
 Les levures désactivées sont devenus un produit commercialisé [59] depuis le début des années 1990 afin de rectifier la trop grande ténacité du
gluten des farines qui rétracte l'allongement et l'abaisse des pâtons destinés
à la confection de baguettes, petola de pizza ou croissanterie. Un peu de
détente, d'extensibilité, face à l'excès de ténacité rétractable, si l'on veut.
Les levures désactivées sont devenus un produit commercialisé [59] depuis le début des années 1990 afin de rectifier la trop grande ténacité du
gluten des farines qui rétracte l'allongement et l'abaisse des pâtons destinés
à la confection de baguettes, petola de pizza ou croissanterie. Un peu de
détente, d'extensibilité, face à l'excès de ténacité rétractable, si l'on veut.
Cet apport de glutathion à effet réducteur est nettement plus développé 20 ans après sa venue sur le marché. Il est permet de comprendre qu'une pâte levurée laissée longtemps en suspens à température ambiante peut procurer ces effets de relâchement. Le plus souvent, un apport partiel de pâte levurée «abandonnée» longtemps aura plus qu'un effet de relâchement et donnera du collant assez rapidement à toute la pâte. Il est certain que la maîtrise de tel ajout (pâte fermentée) est plus hasardeuse qu'avec le produit commercial proposé de plus en plus élargi dans sa gamme de proportion de glutathion [60]. Mais la pratique de l'apport de pâte pré-fermentée bien conduite peut révéler cet aspect «relaxant».
2.4.8. La trop longue protéolyse dans les pâtes ensemencée au levain
Les pâtes au levain ont un autre vécu que les pâtes levurées. Dans un premier temps, parce que l'acidité du levain va régenter [61] différemment les accords qu'il peut y avoir entre les acides aminés[62].
Dans la durée de la panification au levain, le «pont trop loin» existe aussi, bien évidemment.
S'il se maintient bien au début grâce au frein apporté par l'acidification, un dépassement de la protéolyse donne des effets assez dévastateurs. La destruction rapide du réseau est l'accident à redouter puisqu'au bout d'un moment de cette longue fermentation, les bactéries du levain et l'acidité vont influer ensemble. Puisqu'une fois arrivé au pH 4, on est à l'optimum du niveau d'activité d'un de types de protéases de la farine [63]. Et certaines bactéries faisant partie de la microflore du levain possèdent également des protéases. Ajoutons encore que si le gluten est une protéine insoluble dans l'eau, il se dissout plus facilement avec l'acidité.
2.4.9. Les diverses fonctions des acides amimés
Reprenons dans un tableau les acides aminés en décrivant quelques fonctions qu'ils peuvent avoir.
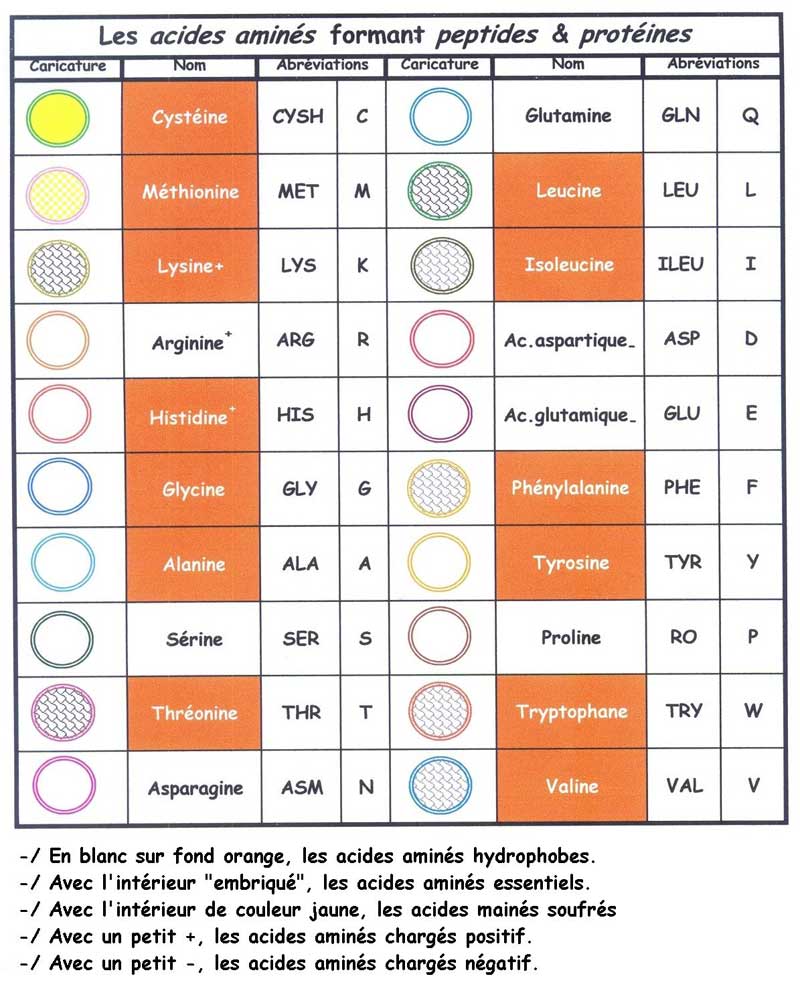
Révélé sous un diagramme de Venn [64], les acides aminés peuvent avoir plusieurs fonctions et ne sont pas en mesure de réaliser tout les rôles de liens hydrophobes, polaires ou hydrogènes.
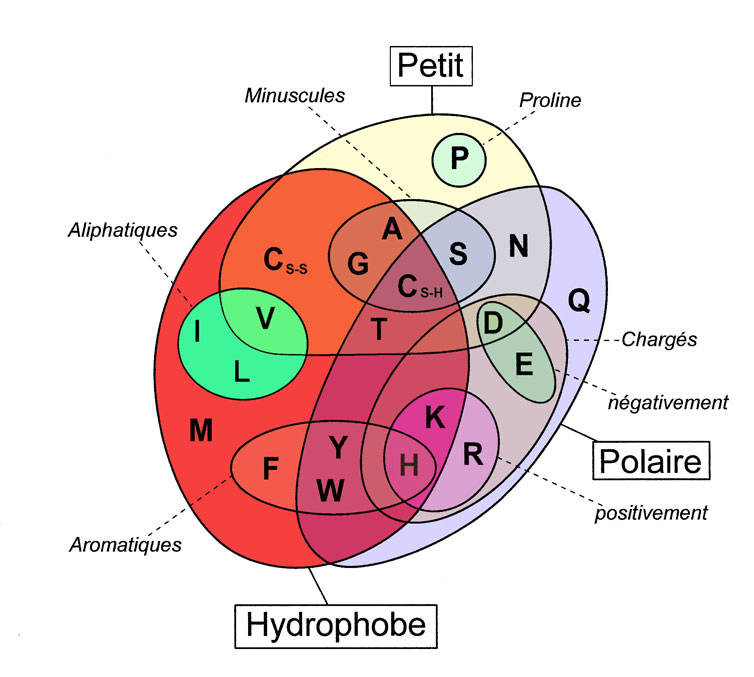
La potentialité des fonctions des acides aminés est complexe et il n'est pas toujours évident d'en tirer une conclusion probante. D'autant qu'en s'associant entre eux, les acides aminés peuvent avoir d'autres fonctions.
2.5. Les hémicellulases et l'hémicellulose
2.5.1. Hémicellulases et hémicellulose, un vécu comme un oubli technologique
Déjà Bernard GODON, 1998 écrit, p. 58, « En général, le terme hémicellulose correspond à la partie insoluble dans l'eau, pentosane à la fraction soluble ». Malgré cela on retrouvera le termes «pentosane» employé indifféremment pour les solubles et les insolubles d'autant que les deuxièmes deviennent partiellement solubles au cours des transformations enzymatiques lors de la panification.
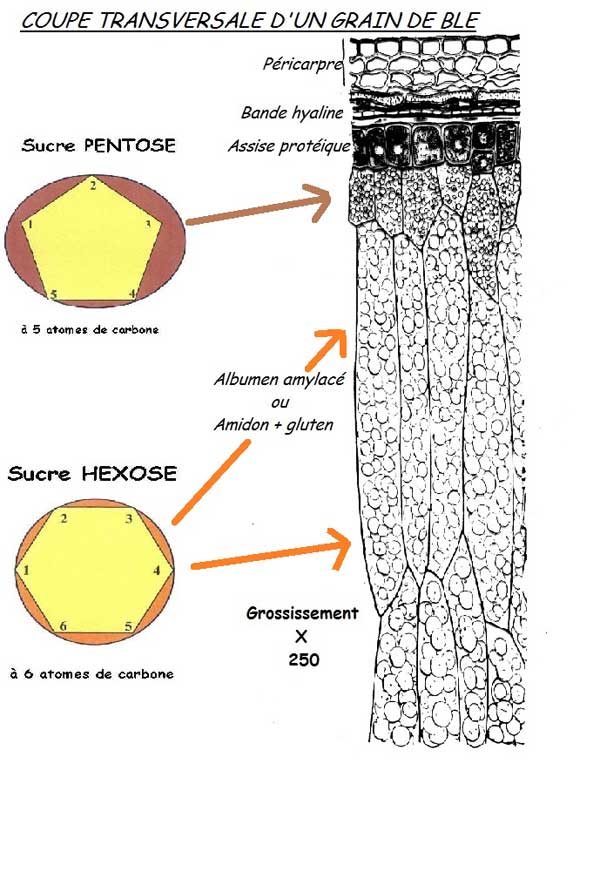
En France, on ne s'est pas beaucoup occupé des pentosanes ou hémicellulases avant le début des années 1990 [65]. Pourquoi ? Parce que la donne était le pain blanc et que les pentosanes ou hémicelluloses se trouvent en quantités importantes à la périphérie d
u grain. Ainsi, parce que les farines «blanches» en contiennent peu [66] et qu'en plus le froment est la céréale qui en contient le moins [67]. On négligera ce que les premiers traités de boulangerie française appelaient le «muqueux» du blé [68] (les hémicelluloses ou pentosanes), au profit quasi exclusif du «glutineux» du blé.
2.5.2 La technologie pour profiter des hémicellulases
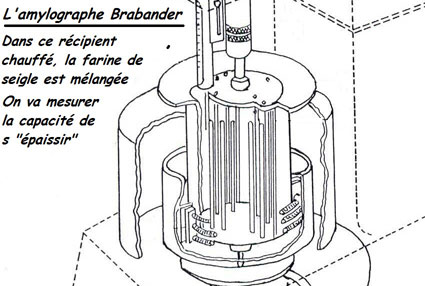
Par contre dans un pays comme l'Allemagne, où la céréale panifiable a été le seigle et où l'entièreté du grain est souvent employé en panification, se sera différent. Il se développera toute une technologie basé sur les hémicelluloses, matière dite dans ce pays ; «épaississante» [69]. Pour cerner la qualité panifiable du seigle, on mesure la viscosité (suite au malaxage, en comptant les ondes émises) [70] d'une masse de farine complète fortement hydratée qui va monter en température (jusqu'à 63°C) afin d'évaluer la potentialité de gélification de la farine. C'est par ce test de viscosité du milieu pâteux que l'on va tenter de cerner la valeur boulangère. C'est tout autre chose que les tests évaluant la potentialité de déformation de la pâte composée de farine «blanche» de froment.
Ici c'est le pouvoir absorbant des hémicelluloses et du gonflement de l'amidon qui s'en suit, qui organise le développement de la mie. Une expansion de la mie qui ne tient pas qu'aux alvéoles, mais qui pense à alléger ce qui entoure ces alvéoles ; l'amidon. A la cuisson par l'eau, retenue puis diffusée par les hémicelluloses [71], l'amidon va alors absorber cette eau et se gonfler. Un peu comme le grain de riz par sa cuisson dans l'eau ébouillantée. Voilà comment s'explique le développement et la légèreté de la mie dans une panification de céréales riches en hémicelluloses. La qualité technologique de la farine ne se juge pas à la seule force de pousse de la pâte, il vous faudra différer l'estimation de la force de pousse au résultat obtenu lors de l'éclatement de l'amidon à la cuisson[72]. Pas évident comme attitude à prendre.
__________________________________
2.5.3. Les hémicellulases natives
On signale [73] des hémicellulases du blé, principalement concentrées dans les parties périphériques du grain et dites en faibles quantités. Leurs activités variant suivant les variétés de froment, elles ont des niveaux d'actions dits faibles aussi par les chercheurs[74]. Pourquoi leurs actions est-elle minimalisée ? Parce que tout simplement des études les déclarent d'un niveau d'activité «très largement inférieurs à ceux des doses d'hémicellulases utilisées en additifs»[75]. On ne part plus de l'expression naturelle comme référence, mais c'est l'addition qui est le repère, on inverse la démarche, là. Pourquoi ? Parce que l'on était déjà habituer au service rendu par ce «travesti» en amylases. En effet, dès l'instant où l'amylase fongique, [76] est apparue sur le marché (1979), des effets secondaires (voir chapitre 1.9.), qui venaient des hémicellulases, seront repérées et employées pendant presque vingt ans sous la dénomination «amylases à activités secondaires»[77] .
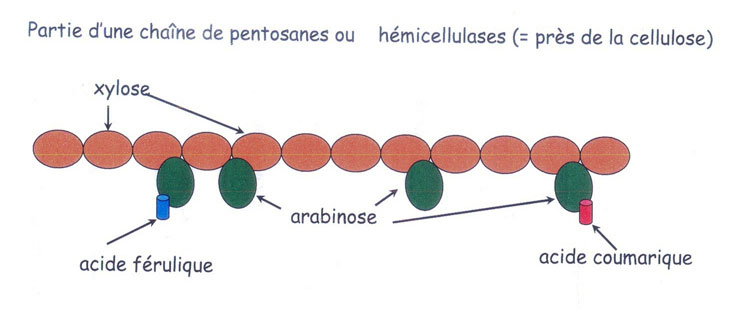
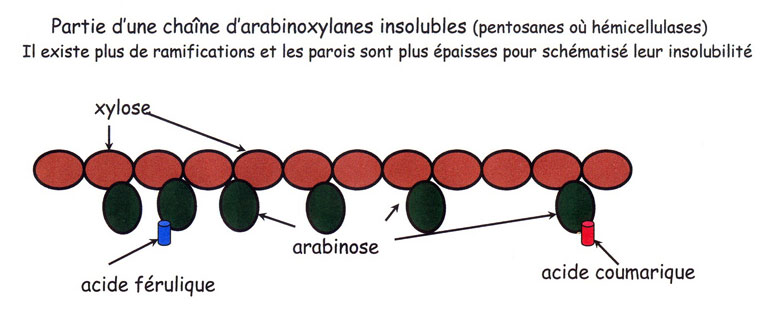
Les hémicellulases ou pentosanases natives du blé auront la possibilité de couper à l'intérieur [78] des chaînes d'arabinoxylanes [79] entre les molécules de xylose et en séparant les molécules d'arabinose attenant [80] à l'ossature de la chaîne de xylose. Ensuite l'action sur les pentosanes insolubles qui en deviennent solubles (10% en fin de pétrissage et 25% en fin de fermentation –levure-) est une des principales actions positives pour la pâte.[81] Peu de littérature existe sur les autres actions que nous verrons plus loin (au chapitre 3.3.1.), bien que des écrits précédant l'arrivée des hémicellulases sur le marché décrivent l'interaction entre gluten et hémicelluloses et que la pratique de longues fermentations observe une présence plus mousse et gommeuse, plutôt que de l'élasticité du gluten. C'est là que l'on soupçonne l'action des hémicellulases sur les hémicelluloses. Une synergie est même développée entre l'élasticité du gluten emprisonnant les bulles de gaz produite par la fermentation et le film d'hydrocolloïdes (la viscosité apportée par les pentosanes) qui tapissent les parois des alvéoles [82] et renforce ainsi les cavités gazeuses de la mie.
Lorsque que l'on dégrade les chaînes de hémicelluloses, les sucres pentoses «simples» (d'une molécule), seront «digérés» par les bactéries de la fermentation au levain [83].
2.6. Les autres hémicellulases et cellulases.
Les écrits sur la dégradation de la cellulose du blé en panification se développent ces dernières années [84]. Il peut être important de savoir que l'enzyme cellulase comme l'enzyme hémi-cellulase n'existent pas en digestion chez l'humain. Cellulose et hémi-cellulose devraient préalablement passer par une fermentation pour se transformer d'aliments en nutriments. La cellulose comporte des matières intéressantes qui sont probablement un peu dégradées dans cette longue fermentation mixte qu'est le levain. Notamment ces autres hémicelluloses (hémi = à moitié en grec ancien), dont le plus repéré est le glucane [85]. Peu d'écrits à notre connaissance, existent au point de pouvoir un peu cerner le sujet. Les moisissures sont encore une fois les principales sources productrices en industrie, de cellulase [86] pour les apports enzymatiques dits alors exogènes.
L'objectif d'un traitement enzymatique des fibres alimentaires (cellulose du blé, ici) est d'une part, une augmentation des fibres solubles et d'autre part une amélioration des propriétés physiques et sensorielles des fibres [87]. On peut aussi penser aux effets formant comme une gomme ou liant appelé parfois gel.
2.7. L'acide phytique, les phytates et la phytase
Avec ces enzymes «phytases», on entre plus dans des descriptifs nutritionnels que technique. C'est pas plus mal.
On sort aussi des dégradations des macro-nutriments (glucides, lipides et protides), pour parler des dégradations des micro-nutriments (ici, sels minéraux et oligo-éléments)
L'acide phytique est un corps naturel des graines (et de la farine en résultant) composé d'acide à base de phosphore.
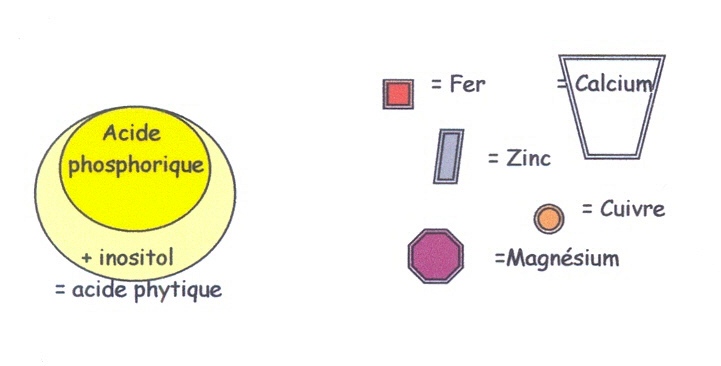
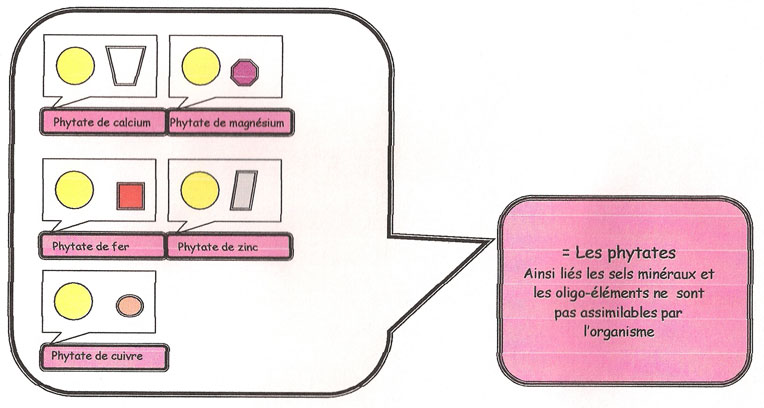
Malheureusement cet acide phosphorique a une affinité particulière pour le calcium, le magnésium et certains oligo-éléments (fer, cuivre, zinc, manganèse) avec lesquels il forme un bloc inséparable (appelé ; phytates). Cette liaison (acide phytique/minéraux) a comme conséquence, que les composés deviennent inassimilables par l'organisme [88]. Encore une fois, l'intervention de séparation sera réalisée par une enzyme dénommée de manière générique ; «phytase».
C'est son action que l'on va décrire.
Une précision importante, cela concerne les minéraux de la farine et de ce fait, les panifications à la farine blanche, +/- 75 % de taux d'extraction en mouture sur cylindres et plus extrait encore, +/- 65% sur meules ne sont pratiquement pas concernées.
2.7.1. La phytase des céréales, le remède vient avec le mal.
Dans la farine complète, « le phosphore est à 80% sous forme de phytates » [89] , c'est-à-dire sous forme de minéraux liés à l'acide phosphorique et difficilement dégradables en peu de temps. D'où le problème de ne pas profiter des minéraux du pain, en termes nutritifs, alors que des carences en calcium, magnésium, fer, sont recensées dans le bol alimentaire actuellement.
Le phosphore, responsable de cette liaison, est présent dans toutes les graines, et bien sur, y compris, les céréales panifiables. G.Spicher écrit que «l'acide phytique (80% du phosphore) est probablement un produit résultant du métabolisme phosphoré de la fermentation et sert de réserve phosphorée, c'est à dire énergétique, ainsi qu'activeur ultérieur pour la germination». [90] C'est tellement vrai que les «voies fermentaires» ou fermentation avaient encore un autre nom en 1967; «phosphorylation», puisque le rôle du phosphore y était considéré comme de «première importance» [91].
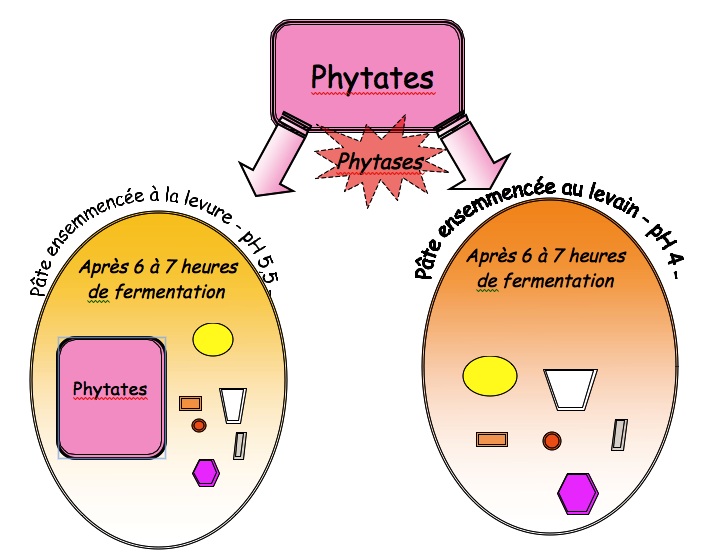
On sait qu'il faudra un temps avant que les sels minéraux liés à l'acide phytique se libèrent. Dans la fermentation, il faudra laisser 6 à 7 heures pour qu'une pâte au levain dissocie totalement l'acide phytique des minéraux [92] et les rendent bio-assimilables.
Si la fermentation au levain réalise en 6/7 heures, une séparation totale des phytates en acide phosphorique et minéraux. Dans la même durée, la fermentation ensemencée à la levure n'hydrolyse que la moitié des phytates [93].
2.7.2. Il faut lui laisser le temps de passer toute les étapes.
« Lors de la germination, c'est du scutellum (sorte de coquille elliptique qui entoure la plantule du germe et la sépare de l'amande farineuse) que partiront les actions, qui par dégradation enzymatique, mettront l'amande farineuse à la disposition de la plantule»[94]. Cela c'est pour suivre les voies germinatives autant que fermentaires. Comment et pourquoi, après avoir été bloquant, le phosphore devient l'énergie qui permet de créer un processus de vie, prenons un exemple.
Sur une toute petite parcelle de la transformation enzymatique qui se réalise dans la panification, celle du glucose en acide pyruvique (vu plus haut ; chapitre 2.3.7.). Celle-ci requière dans la douzaine d'opérations enzymatiques, des transformations qui consomment de l'énergie et d'autres qui apportent de l'énergie.
Pour la première opération de dégradation du glucose, c'est l'atome de phosphore donné par une molécule qui en possède trois (l'ATP) [95] qui déclenche l'énergie nécessaire et qui sera pour cette raison, appelé par les bio-chimistes, l'enzyme-clef de la glycolyse.
3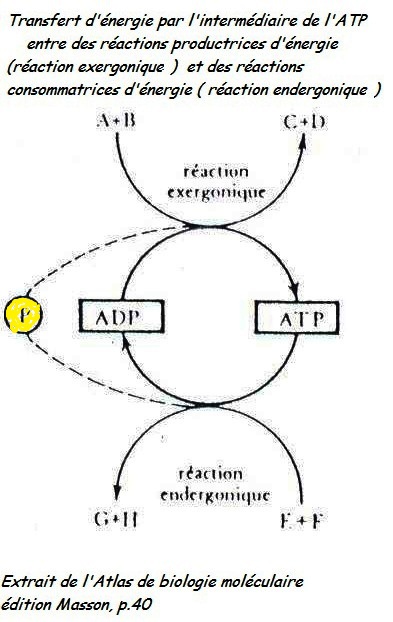
La première porte s'ouvre. C'est donc le phosphore qui apporte l'énergie pour que celle-ci permette la dégradation de la molécule de glucose et dans la germination afin de redonner une nouvelle plante.
Il est également normal ou naturel que cette naissance de la nouvelle plante ou vie à partir du germe, ne se déclenche que suivant des paramètres (acidité, humidité, température) qui lui garantisse de pouvoir continuer au mieux son but. On le perçoit par cette autre observation ; la biodisponibilité des minéraux réduite dans un premier temps par l'effet chélateur de l'acide phytique (liant et bloquant l'assimilation des minéraux) existent dans la nature comme un effet de frein que les scientifiques appellent « pouvoir tampon »[96]. En somme encore une barrière ou porte à passer (un mot de passe de plus) afin que se confirme les conditions de germination en allongeant les étapes ou portes à franchir.
Si l'on place la problématique de l'acide phytique dans la nécessaire dégradation des aliments afin que ceux-ci prennent le statut de nutriments. Le frein, puis la libéralisation du phosphore (ou phosphorylation et déphosphorylation du langage scientifique d'autrefois) va finir par apporter l'énergie à bien de dégradations positives. La voie naturelle de ces transformations enzymatiques, (surtout par la longue auto-fermentation et la conservation de l'entité des éléments du grain), va dans l'exemple de la glycolyse décrite plus haut, transmettre deux atomes de phosphore dans le premier temps et les récupérer dans la deuxième partie (voir schéma). Ainsi cela peut repartir pour une autre transformation de molécule de glucose. L'enzyme et le phosphore auront une action perpétuelle et pourront continuer leurs fonctions de germination, de fermentation et de bio-assimilation des nutriments.
C'est réglé comme un mouvement d'horlogerie.
Il suffit simplement de le respecter.
On remarque dans la colonne de gauche du tableau qui suit que l'énergie nécessaire aux transformations enzymatiques est apporté par le phosphore Celui est emprunté à une molécule qui possède trois atomes de phosphore (ATP = Adénosine Tri Phosphate) dans la première partie de la glycolyse (fermentation du glucose). Après la scission en deux parties de la molécule dégradées, un apport de deux molécules de phosphore organique entre dans le processus de dégradation. Dans la seconde partie, c'est ainsi quatre atomes de phosphore énergétiques qui rendues à des molécules ADT (Adénosine Di-Posphate) redevienne Tri-Phosphate et sont prête en double pour de nouvelles transformations de molécules de glucose.
[1] La bonne teneur en nutriments du germe est bien connue. Réputé, il y a comme principal attrait, la teneur en vitamines B et vitamine E (le scutellum -partie périphérique du germe- contient 60 à 70 % des vitamines B1 du grain). On a déjà décrit la teneur en lipides (15 %). La teneur en protéines est de 30 à 40 % sur mat.sèches et 5 à 6 % d'éléments minéraux. Voir ; Extraction du germe de blé en mouture, Claude WILLM, en 2005, p. 23.
[2] Le germe ne faisant que 3% du grain, contient près de 14/15 % de lipides du grain de blé, la couche d'aleurone, 8 % du blé, prend 24 % des lipides. L'albumen, 84 % du blé, a 62% des lipides. Synthèse d'après les renseignements que donne Bernard GODON en 1991.
[3] Jacques POTUS, F. EL AMRANI, V.AMEILLE et N.KAID, 1996, p.11. Ce qui va permettre aprés l'hydrolyse, l'action enzymatique d' oxydation des protéines afin d'obtenir la maturité de la farine
[4] Dans la farine et par la faible teneur en eau de celle-ci, les probabilités de rencontre entre molécules sont limitées.
[5] Les observations des modifications apportées lors de la maturation des farines sont principalement dues aux lipases qui en hydrolysant alimentent l'action oxydante des lipoxygénases sur les protéines. Dans les premières semaines cela apporte une augmentation des ponts disulfures qui diminueront progressivement au-delà, voir Philippe CASTELLO, J.POTUS, J.-L. BARRET et J. NICOLAS, en, juillet 1998, p. 5 à 13.
[6] Les recommandations de l'Asso. Nation. de Meunerie Française (ANMF) concernant la Durée Limite d'Utilisation Optimale (DLUO) est de 9 mois pour une farine «blanche», de type 55 et 65, et de 4 mois pour le type de farine intégrale (T 150). Voir Ph. WIRSTA & coll., en mars 2006, p. 9 à 13.
[7] Jacques POTUS, F. EL AMRANI, V.AMEILLE et N.KAID, 1996, p.12.
[8] R.DESGREZ, p. 139 à 145, signale que les corps gras à chaîne courte (type beurre par exemple) sont plus sensible à l'hydrolyse enzymatique avec une risque dit de saponification en terme d'altération. Tandis qu'une fois commencée l'action des enzymes oxydantes s'accélère progressivement et ceci en fonction de la nature du corps gras (ce qui peut multiplier la vitesse d'oxydation par 10 ou 30), du taux de présence d'anti-oxygène naturels (tocophérols) ou de synthèse (additif) et de présence de lumière, chaleur et traces de catalyseurs «chimiques» du type fer, cuivre, manganèse.
[9] L'activité de l'enzyme lypoxygénase de la farine de fève (une enzyme oxydase, cette fois) est 100 fois supérieure à l'activité de la lipoxygénase du blé. Elle peut être encore triplée (300 X), s'il s'agit de farine de soja plutôt que de farine de fèves ; Philippe ROUSSEL, 1998, p.596 à 602.
[10] Dans les années 1970, arrivé à un plafonnement de l'intensification du pétrissage, l'ajout de farine de fève (et plus rarement de soja) contenant plus d'enzyme oxydante (la lipoxygénase - LPOX) contribuait largement dans la pâte ainsi pétrie à détruire les pigments caroténoïdes et produire un gaz (l'hexanal) qui dénaturait le goût du pain et le rendait fade, voir ; R.DRAPRON, Y.BEAUX, M.CORMIER, J.GEFFROY et J.ADRIAN, 1974.
[11] Au lieu de 1% des sucres simples contenue dans une farine «blanche» (voir chapitre 0.19), les «remoulages» issus de la périphérie du grain en contiennent jusqu'à 10% ; Michel BERGER, p.40.
[12] Au lieu des +/- 15 % de protéines solubles contenues dans les protéines totales d'une farine, les enveloppes du grain contiennent 30 % de protéines solubles dans le total des protéines, soit le double. Voir, Yves DACOSTA, p. 29.
[13] Les actions germination / grain & fermentation / farine, suivent les mêmes types de dégradations.
[14] Le tableau est repris d'une étude de 1925 par V. KULVINSKA publié dans CAYLA Michèle, en 1982. René GEOFFROY, 1950, p.213 cite des travaux de PRINGSHEIM en 1926 démontrant une augmentation de 30% de l'amylolyse au bout de 6 heures avec l'adjonction de jus de levure bouilli. Ajoutons qu'au début du pétrissage, une production de maltose est multipliée par 47 avec 350 à 700 rotation de l'axe pétrisseur, suite probablement à la favorisation de renouvellement des contacts enzymes/substrat dans cet apport de brassage mécanique ; Annie POIFFAIT, Jacques POTUS et Roger DRAPRON, juin 1993, p. 8 à 10. Encore faut-il que la levure en profite en assimilant ce maltose. Ph.ROUSSEL (1998), p.580, écrivant la composition de la farine de malt (30h. à +/- 65°C) donne 58,55% d'amidon, 9,32% de dextrines, 4,35 de maltose et 2,73% d' indéterminé.
[15] Ces sucres dits «libres» par V.LELOUP, P.COLONNA & A. BULEON en 1991, p.79, ils sont composés de moins 0,1% de fructose, moins de 0,1% de glucose, 0,5 à 2,3 % de saccharose et 0,1 à 0,3 % de maltose et homologues supérieurs. Voir aussi les références plus anciennes, chapitre 0.19.
[16] Un repère professionnel pour les boulangers qui ont ce vécu. C'est le principe de conduire une pâte au levain sur plusieurs rafraîchis amène à introduire dans la pâte finale, une grande proportion de pâte ayant subit une fermentation. Ainsi l'amidon est transformé et la dégradation a réalisé une «bonne transformation des sucres». Une saveur plus sucrée, voire «miellée», se rapprochant du goût «malté» en résulte.
[17] Historiquement, le premier sucre décrit provient de la canne à sucre (qui est composé essentiellement de saccharose). Comme souvent, l'antériorité donnera au saccharose, une prévalence dans les différentes déterminations ; ici du sucre. Par exemple, l'unité sucrante 1, est le pouvoir sucrant du saccharose, tous les autres sucres, inclus édulcorants intense, se référeront à cela. Le saccharose sera aussi appelé sucrose comme l'enzyme portera indifféremment plusieurs dénominations ; saccharase, sucrase et invertase, vu à la note suivante.
[18] Bernard POITRENAUD, en 1994, p. 177.
[19] C'est un des premiers travaux publié de Louis PASTEUR et qui lui ouvrira la porte de la notoriété scientifique; Mémoire sur la relation qui peut exister entre la forme cristalline et la composition chimique, et sur la cause de la polarisation rotatoire, Paris 1848.
[20] En plus des Saccharomyces cerevisae, à notre connaissance, seuls l'espèce de levure Candida tropicalis a été recensée dans les levains comme possédant également la faculté de dégrader (ou assimiler) le maltose, voir C. GANCEDO et R.SERRANO, en 1989, p. 211.
[21] Deux tableaux (celui des bactéries lactiques et celui des levures) sont refondus pour une meilleure lecture. Ils sont extraits de Gottfried SPICHER, 1987, p. 75 et 95
[22] T.LENDER, R.DELAVAULT et A. LE MOINGE en 1992, p.332 ; «Le phénomène de perméation (transport actif à l'intérieur des cellules) reste hypothétique chez les eucaryotes (cellules possédant un noyau, comme les levures) et il est mieux connu chez les bactéries» (ne possédant pas de noyaux).
[23] Michel BERGER, en 1983, p. 42. Voici des extraits ; «…la disparition rapide du saccharose et des hexoses (maltose, lactose, mélibiose) avant que ne puisse se constater réellement la métabolisation du maltose fourni par l'amylolyse. …la quantité de maltose produit est donc le facteur limitant de la production de gaz carbonique…» L'auteur constate «deux zones de production de gaz …la première correspond à l'utilisation des sucres préexistants directement fermentescibles et la seconde à celle du maltose produit. Entre les deux, on constate une diminution du débit de gaz carbonique correspondant à la période de transition». «On doit cependant remarquer … que la sélection des souches commercialisées (de levures) ne permet plus de visualiser aussi nettement ce phénomène.»
[24] Bernard POITRENAUD écrit en 1994, p.177 que c'est de Grande-Bretagne et pour s'adapter au procédé de panification rapide dit C.B.P. (Chorleywood Bread Process) mis au point au centre de recherche de Chorleywood au nord de Londres que l'on rechercha des levures a action rapide, début des années 1960. Ces souches de levure seront ensuite utilisées sur le continent où se développait le pétrissage intensifié qui insidieusement réduit le temps de fermentation. Plus on pétrit, moins on fait fermenté et plus on fait fermenté la pâte, moins on a besoin de pétrir.
[25] Bernard POITRENAUD, 1994, p. 178, emploi les expressions ; «levure à adaptation lente au maltose» et «levure à adaptation rapide au maltose».
[26] Ce tableau est repris de la communication de Philippe CLEMENT, 1983, p.23.
[27] L'activité de l'αlpha-amylase est métallodépendante au calcium, (qui est plus présent dans la farine complète que dans la farine blanche ; 2,5 fois plus). Voir V.LELOUP, P.COLONNA & A. BULEON, qui p.82 signalent que l'ion calcium stabilise la structure de l'enzyme et agit comme activateur, mais le calcium peut aussi être inhibiteur de la βêta-amylase, c'est du moins ce qu'écrivent C.MERCIER et M.T.TOLLIER, 1984, p.320.
[28] Voir ; V.LELOUP, P.COLONNA & A. BULEON, 1991, p.86.
[29] L'action «dextrinisante» est la résultante des coupes à n'importe quel endroit à l'intérieur de la chaîne d'amidon, sauf aux branchements, procurant des bouts d'amidon, soit des dextrines.
[30] L'action a été appelée «saccharifiante» au début puisqu'elle apporte en résultat de dégradation une paire de molécules de sucres, dans le cas de l'amidon, appelée maltose, et non pas saccharose (aussi une paire de molécule, voir chapitre 0.19., mais de composition différente) comme le pourrait laisser penser la dénomination générique et assez ancienne de l'action.
[31] Voir ; V.LELOUP, P.COLONNA & A. BULEON, p. 122
[32] Voir V.LELOUP & coll., déjà cité, p.124.
[33] Markus BRANDT, Michael GÄNZLER, 2006, p. 113 à 115
[34] Markus BRANDT, Michael GÄNZLER, 2006, p. 115 à 120.
[35] Bernard POITRENAUD, 1994, p. 175.
[36] Bernard ONNO et Philippe ROUSSEL, 1994, p. 306 & 307.
[37] Gottfried SPICHER et Hans STEPHAN, p. 200 à 208 et Markus BRANDT, Michael GÄNZLER, p. 115 & 119.
[38] Voilà la définition qu'Emile DUFOUR donne de la savate dans son écrit sorti droit du fournil, en 1937, p. 178, Savate : Mauvais travail, vilain pain.
[39] Lionel POILÂNE, 1981, p.104, donne l'expression «ton levain est pourri» (mot qui signifie trop fermenté).
[40] Jacques POTUS F. EL AMRANI, V.AMEILLE et N.KAID, 1996, p.10 & 11.
[41] Léon BOUTROUX en 1897, déjà cité, p.170, signale que l'altération du gluten donne des qualités de saveur et de digestibilité recherchée par le consommateur. Le Manuel de boulangerie-pâtisserie suisse, 1949, p.67 dans sa description de la dégradation des protéines en peptides pour finalement arriver aux acides aminés, est vu comme un apport de substances aromatiques.
[42] Il s'agit de la réaction dite de Maillard, qui n'est pas issue de transformations enzymatiques.
[43] Dans le Handbuch Sauerteig, de 2006, Markus BRANDT, développe 7 pages sur le sujet, p.21 à 27.
[44] Le glutamate ou plus précis, le glutamate monosodique est un des sels de l'acide glutamique, il est fréquemment utilisé dans la cuisine du sud-est asiatique. Voir ; J.-M. BELIN et F.HUSSON, en 1997, p.271. Y.DACOSTA, 1986, parlant p. 86 à 91, d'hydrolyse du gluten ayant comme objectif, l'aspect renforçateur ou apporteur d'arômes, indique que l'hydrolyse doit être plus forte. Même si c'est les hydrolysats de gluten qui possèdent le taux le plus élevé de monoglutamate de sodium (21%), par rapport à des résultats d'hydrolyse de maïs (12%) et de soya (7%), cela ne se traduit pas par une supériorité en tant qu'exhausteur d'arômes à l'égard des autres hydrolysats.
[45] Le degré d'amertume serait lié à la teneur en acides aminés hydrophobes qui composent le peptide, P.ROY et P.DURAND, en 1997, p.109. La maturation de certains fromages peut présenter également ce risque d'apparition de peptides amers.
[46] Y.POPINEAU, P.MASSON et J.-L. THEBAUDIN, 1991, qui p.147 & 151 relatent ce risque de formation de peptides amers par la réduction de la taille des peptides.
[47] Gottfried SPICHER, 1987, p. 108 qui recense cette production d'amer par Paracolobactrum coliforme (syn. Bactérium coli) et Mycroccocus pyogenes.
[48] G.SPICHER, E.RABE et Chr.ROHSCHENKEL, en avril 1987, p. 118 à 122 et S.BARBER et BAGUENA, en 1989.
[49] La liaison peptidique se fait entre le groupement acide (COOH) d'un acide aminé et le groupement amine (NH2) de l'autre. Au cours de la réaction, une molécule d'eau est éliminée. Il s'agit d'une action enzymatique d'hydrolyse, dite ici protéolyse qui condense, réticule.
[50] C'est comme si on enlevait l'atome d'hydrogène venu se fixer entre les deux atomes de souffre et l'on recréait le «pontage disulfurés», c'est un image que j'aime beaucoup et qui peut se comprendre par les figures du chapitre suivant, 2.4.7. Ce «resserage» se réalise mieux après une légère levée de la pâte. Trop lévé (ou trop d'écart) la pâte a difficile à se «relier».
[51] Ce type de liaison va réagir et être utile dès l'ajout d'eau dans la farine, en fixant une molécule d'eau, elle favorise la viscosité. Y.DACOSTA, p.15 cite les acides aspartique et glutamique, l'arginine, l'histidine et la lysine
[52] Ce type de liaison, va entre autres, lier les protéines entre elles ainsi qu'aux glucides (pentosanes, notamment) et lipides. Yves POPINEAU, P.MASSON et J.-L.. THEBAUDIN, p. 129 écrit «l'hydrolyse des protéines permet d'obtenir des peptides où des protéines plus courtes qui peuvent être différentes après les coupures, car celles-ci sont souvent accompagnées de réarrangements (en phase aqueuse, à cause des propriétés hydrophobes) qui ont de nouvelles propriétés fonctionnelles, nutritionnelles et biologiques». Plus loin, p. 132, il écrit «Les prolamines riches en souffre (beaucoup de gliadines & les gluténines à faible poids moléculaire) ont une forte teneur en acide aminés hydrophobes.» Y.DACOSTA, p. 14, cite les acides aminés apolaires comme hydrophobes (alanine, glycine, valine, leucine, isoleucine, phénylalanine, cystine, proline & méthionine).
[53] Ces appareils ont été accusés par certains Etats de publicité mensongère et parfois des accusations d'imposture médicale sont également recensées sur ces ventes d'appareils apportant aux dires des concepteurs une air aussi «tonifiante» que celle que l'on rencontre près des chutes d'eau.
Y.DACOSTA, p. 17, signale que le caractère cationique (= charge +) où anionique (= charge -) varie fort suivant l'acidité du milieu. Peu ou pas d'analyses à ma connaissance ont été réalisées sur des pâtes au levain à pH différent d'une pâte levurée. De plus, comme le signale Y.DACOSTA dans son ouvrage bibliographique sur le gluten, la fixation d'ions minéraux (la pâte est salée et la farine complète comporte des minéraux) modifie la charge globale.
[54] P.ROUSSEL & H.CHIRON, p.79, résument dans un encadré toutes les liaisons et notamment les ioniques (c'est encore plus de la physique ici) entre les ions chargés négativement et positivement. J.POTUS, F. EL AMRANI, V.AMEILLE et N.KAID, 1996, p.11, écrivent que «les protéases endogènes de la farine hydrolysent les liaisons peptidiques de préférence au niveau des acides aminés chargés positivement, ce qui explique leur faible activité sur les protéines –insolubles- du blé dans lesquelles les acides aminés basiques sont en faible proportion.» Ce qui signifie que les «résidus» ou «molécules» donneurs d'ions positifs n'ont pas assez de «résidus» récepteurs d'ions.
[55] C'est l'élimination d'un atome d'hydrogène qui permet à deux atomes de soufre de se souder. Cette oxydation se réalise à la fermentation et plus rapidement par l'ajout d'agents ou auxiliaires technologiques à pouvoir oxydo-réducteur (par ex. : l'acide ascorbique ou enzyme oxydante ; type glucose-oxydase ou hexose-oxydase).
[56] J.-Y.LEVEAU, en 1983, p.6.
[57] Bernard POITRENAUD, signale , p. 174, qu'en anaérobie (vie sans air, par exemple ; dans la pâte) et ainsi en «panification, la durée des schémas est trop courte pour envisager une quelconque multiplication de la levure dans la pâte. Ce que l'on peut simplement constater, c'est une augmentation du taux de bourgeons qui atteint 40 à 50 % après quatre heures de fermentation.». Il faut compter beaucoup plus de temps à température ambiante pour avoir une petite partie des levures de la pâte qui s'auto-lyse et libèrent leurs contenus.
[58] Bernard POITRENAUD, 1994, p.175 qui cite l'apport de tous les acides aminés essentiels, phospholipides, minéraux et vitamines. C'est au point que les levures désactivées sont recommandables en supplément vitaminique dans l'alimentation humaine.
[59] Stéphane BEAGUE et Vincent LECHEVALIER, de la société Lesaffre, en 2005, p.29 à 37.
[60] S.BEAGUE et Vincent LECHEVALIER, p.31 qui présentent quatre types de levures désactivées de leur firme avec des teneurs en glutathion jusqu'à 8 fois plus importante que dans la levure standard.
[61] Pour la panification du seigle Gottfried SPICHER et Hans STEPHAN, 1987, p.44 à 49, consacre un chapitre à l'effet «régularisateur» du l'acidité du levain sur l'activité des enzymes. Au pH 4 -4,5, les amylases du seigle sont «calmées» et les pentosanases «activées», deux cas de figure positifs.
[62] Coté observation pratique, Raymond CALVEL, en 1979, p.57, écrit «le levain facilite l'utilisation de farines faibles (en gluten)». Plus analyste, Y.DACOSTA, en 1986, p. 17, parle de l'influence du pH (acidité ou mieux pouvoir d'Hydrogène) qui permet de fixer les protons H+ et augmenterait les liaisons ioniques.
[63] Il existe deux grands types de protéases natives du blé. Un type actif en milieu acide (autour du pH 4), on cite l'aspartyl-protéase et l'autre type active en milieu basique (entre les pH 7 & 9). Y.POPINEAU, P.MASSON et J.-L. THEBAUDIN, en 1991, p. 145. Les protéases alcalines sont plus rapides dans l'hydrolyse, elles ont été utilisées pour la fabrication d'hydrolysats de protéines de céréales pour y apporter des propriétés moussantes et émulsifiantes. B.ONNO et P.ROUSSEL écrivent p. 309, que «le pH optimum des protéases est voisin de 4, l'acidification de la pâte favorise leur activation».
[64] John VENN (1834-1923), améliora la représentation géométrique de Léonhard EULER (1707-1783) pour classer dans un seul schéma les attributions différentes et similaires.
[65] Voir pour de plus amples renseignements, ceux repris en commentaires dans les notes du chapitre 1.14.
[66] G.SPICHER, 1987, p.40, donne pour le seigle une répartition de «…30% des pentosanes du grain dans l'amidon , les 70% restants se trouvent dans l'écorce».
[67] Voir le tableau présenté au chapitre 1.14. qui donne un rapport de teneur supérieur de 150% pour le seigle complet vis-à-vis du froment complet. Si on ajoute le pourcentage repris à la note précédente pour comparer seigle complet à froment «blanc», on part dans un rapport de 1 pour le froment «blanc» à 5 pour le seigle complet.
[68] PARMENTIER, p.25, après avoir décrit, en1778, le son de blé et la matière glutineuse et avant d'aborder l'amidon, parle «du muqueux du blé», qui était au XVIIIème siècle le nom générique de la substance farineuse. Ce muqueux, écrit-il «a une saveur sucrée, attire l'humidité de l'air, poisse les mains, se dissout aisément dans l'eau froide. Le muqueux du blé se trouve distribué dans toutes les parties de la fructification des plantes qui sont nutritives»
[69] On retrouvera les hémicelluloses ou pentosanes sous plusieurs appellations dans les diverses disciplines scientifiques, ce qui va permette de cerner la matière. Polysaccharides non amylacés, gommes ou alors sont inclues dans un nom de matières soit muqueuses, mucilagineuses, gélifiantes, épaississantes, colloïdes ou visqueuses. En terme diététique il s'agit souvent de fibres alimentaires solubles ou pas. Les noms de sucres simples (arabinose ou xylose) qui les composent ou l'arabinoxylane le sucre composé des sucres précités est plus précis en terme scientifique. X.ROUAU, p. 13 écrira même que les enzymes hémicellulases sont appelées «trivialement, pentosanases».
[70] L'analyse réalisée à l'amylographe Brabender (l'appareil de mesure qui a le plus évolué) prend le plus haut niveau d'une courbe, celle-ci mesurant par corrélation entre la viscosité de farine ou grain concassé en suspension dans l'eau, soumis à un mouvement de rotation et avec l'élévation progressive de la température, elle évalue à la fois la viscosité et la potentialité de gélification de l'amidon. La viscosité en mesurée en AE, c.a.d. en Angstroem, une unité de mesure de longueur d'onde. Voir J.-M. BRUMMER, p.99 & 100. Voir pour des infos plus complètes, le dossier Pentosanes sur B.N.
[71] Les pentosanes ont une capacité d'absorption d'eau de +/- 8 fois leur poids d'eau. Alors que le gluten ne retient que 1,8 fois son poids. Même s'il y a 4 fois moins de pentosanes que de gluten, ce sera encore les pentosanes qui prendront la plus grosse charge.
[72] Vécu de fournil, lorsque l'on observe à l'enfournement d'une pâte «jeune» que celle-ci se développe ou «éclate» mieux au four, qu'un pâton enfourné au maximum de développement et rétention gazeuse.
[73] X.ROUAU, p. 16
[74] X.ROUAU, p. 17, qui signale l'action sur les pentosanases insolubles qui deviennent solubles (10% en fin de pétrissage et 25% en fin de fermentation –levure-) Ce qui est une des principales actions positives pour la pâte.
[75] X.ROUAU, p. 16. Précisons aussi que la panification a évolué en raccourcissant parfois à une partie de plus en plus congrue l'espace temps de fermentation. Souvent en éliminant les pré-pâtes (levain, poolish) et en diminuant le pointage au profit de l'apprêt, la farine n'a plus eu beaucoup de temps pour absorber l'eau. Le rôle des pentosanes (capter l'eau) s'en retrouvera amenuisé.
[76] H. PETRICH-MURRAY et P.DUCROO, p. 14 qui donne l'espèce Aspergillus niger et par après l'Aspergillus awamori
[77] H. PETRICH-MURRAY et P.DUCROO, p. 14 écrivent «Pour des raisons diverses, ces enzymes -hémicellulases- sont apparues en panification sous l'appellation : amylases à activités secondaires. Très vite ces activités dites secondaires sont apparues comme principales».
[78] Elles sont souvent appelées endo-arabinoxylanes
[79] X.ROUAU, p. 14, Ces chaînes sont linéaires comme l'amylose (voir chapitre 0.16.) et comporte de 100 à 500 molécules.
[80] H. PETRICH-MURRAY et P.DUCROO, p. 14, donnent le ratio molécules de xylose/molécules d'arabinose, il est de 2/1. Plus les cellules d'arabinose sont scindées de la chaîne de pentoses, plus vite la dégradation de xylose s'opérera par les endo-xylanases (qui coupent la chaîne à partir de l'intérieur de celle-ci)
[81] X.ROUAU, p. 17 & 18. Les pentosanases en dégradant les hémicelluloses insolubles limite les interruptions dans le film de gluten par des inclusions fibreuses et renforce en viscosité ce même film. H. PETRICH-MURRAY et P.DUCROO, p. 13 écrivent que ce qui différencie les pentosanes insolubles des pentosanes solubles est le poids moléculaire et le degré de ramification interne, supérieures dans les premières citées.
[82] X.ROUAU, p. 18.
[83] H. PETRICH-MURRAY et P.DUCROO, p. 14.
Il est clair que beaucoup de bactéries lactiques possèdent des pentosanases puisqu'elles fermentent le ribulose et le xylose (deux pentoses) par la voie fermentaire d'ailleurs dénommée ; voie des pentoses. Les bactéries lactiques hétérofermentaires emploie cette voie et les bactéries lactiques homofermentaires falcultatives également, lorsqu'elles fermentent les pentoses, voir ; F.DELLAGLIO et co.; Caractéristiques générales des bactéries lactiques.
[84] Guylaine LACAZE, M.WICK, S.CAPPELLE, Emerging fermentation technologies: Development of novel sourdoughs, Revue Food Microbiology, n° 24 de 2007, p. 155–160 emploi souvent l'expression «dextranes»
[85] Le glucane se situe également à la périphérie du grain et spécialement pour l'avoine et l'orge. Il est composé comme l'amidon de molécules de glucose accolées l'une à l'autre.
[86] Voir J.-P. LARPENT et M.LARPENT-GOURGAUD, p.360.
[87] Renato AMADO, Eva ARRIGONI et Andrea CAPREZ, Effets des traitements sur les propriétés physico-chimiques, publié dans Les fibres alimentaires, éd. APRIA, 1987.
[88] Voir pour une information approfondie sur le sujet, le dossier Pain complet déminéralisant ou acide phytique sur le site boulangerie.net
[89] Carole ANTOINE & col., p.6
[90] G.SPICHER (1987), p. 47.
[91] Voir : Eugène AUBEL, p.27 à 35.
[92] Voir les enquêtes sur le sujet réalisées par J.G.REINHOLD, p. 38-41, R.HAUSPY, p. 27, H.J. LONKHUYSEN, p.101.
[93] TER-SARKISSIAN et col., p.651-653. Ce dernier auteur signale l'existence de deux barrières définie par le niveau d'acidité pour arriver à hydrolyser les phytates complètement. Ce qui différencie les résutats obtenus par le levain par rapport aux pâtes ensemencées à la levure.
[94] Henri NURET, cité dans Claude WILLM, p. 23.
[95] L'ATP = Adénosine Tri Phosphate devenant ainsi de l'ADP ou Adénosine Di Phosphate. On appelle les enzymes comportant l'atome de phosphore de l'ATP avec le terminal « kinase ».
[96] G.SPICHER, p. 141 à 143, consacre un sous-chapitre à cet effet tampon des matières minérales de la farine dans le levain, au point d'utiliser la phytine comme régulateur voir stabilisateur de l'acidité, comme l'emploi du sel en fermentation panaire. Un ajout de phytate (0,1 à 1 gr.) est jugée apropriée lors de la méthode de conduite du levain en continu (procédé industriel). Chez le même auteur, p. 48 on lit « Par leur faculté d'effet-tampon, les phytates contribuent dans la solution a ce que le pH du levain reste assez longtemps dans un secteur optimal pour la phytase (pH optimum : 5,0 à 5,5)»
Janvier 2012









