Les oxydoréductases en panification
Résumé
Au cours du pétrissage de la pâte boulangère interviennent des réactions de réduction conduisant à son affaiblissement par dépolymérisation des protéines, notamment si le pétrissage se prolonge. Cependant, en présence d'air, le moindre apport d'oxygène amorce des réactions d'oxydation dont l'une, inverse de la précédente, est la formation de ponts disulfures entre les protéines résultant de leur oxydation couplée par les hydroperoxydes d'acides gras formés par l'intermédiaire de la lipoxygénase, et une autre pourrait être la formation de ponts phénoliques entre protéines et arabinoxylanes par l'intermédiaire de la sulfhydryle oxydase et de la peroxydase.
Il en résulte une coexistence des réactions de polymérisation et de dépolymérisation. Il est d'usage de favoriser les premières par l'intensification du pétrissage augmentant l'apport d'oxygène ou par l'incorporation de farines de légumineuses riches en lipoxygénase mais aussi par l'emploi d'acide ascorbique, de glucose oxydase ou d'autres oxydoréductases.
L'acide ascorbique, par l'intermédiaire de l'acide ascorbique oxydase et de la glutathion déshydrogénase, fait basculer les thiols rhéologiquement actifs vers leurs formes oxydées les rendant indisponibles pour participer aux réactions de dépolymérisation. La glucose oxydase et la sulfhydryle oxydase produisent du peroxyde d'hydrogène, substrat d'une peroxydase endogène, catalysant la formation de ponts phénoliques entre macromolécules protéiques et glucidiques. En outre, la sulfhydryle oxydase oxyde les thiols peptidiques.
Mots clés : lipoxygénase, peroxydase, catalase, polyphénol oxydase, acide ascorbique oxydase, glutathion déshydrogénase, glucose oxydase, sulfhydryle oxydase.
Introduction
En technologie de panification, l'importance des phénomènes d'oxydoréduction qui se produisent au cours du pétrissage est largement reconnue, notamment en ce qui concerne le couple disulfure-thiol et ses conséquences sur les propriétés rhéologiques des pâtes (BLOKSMA et BUSHUK, 1988) ou en ce qui concerne l'oxydation des acides gras polyinsaturés et ses répercussions sur les qualités organoleptiques du pain (DRAPRON et al., 1974).
Ces réactions peuvent se produire spontanément ou être catalysées par des métaux. Cependant, la présence d'enzymes accroît fortement les vitesses de réaction tout en les orientant vers la production d'un métabolite privilégié.
Nous nous proposons de passer en revue les différentes enzymes aptes à catalyser les réactions d'oxydoréduction – comme nous l'avons fait pour celles catalysant des réactions d'hydrolyse (POTUS et al., 1996) – en insistant sur les conséquences de ces réactions sur les caractéristiques des pâtes et les qualités du pain.
Il convient toutefois de préciser que les enzymes peuvent être endogènes à la farine mais qu'elles peuvent être aussi volontairement ajoutés à la farine – au stade meunier ou boulanger – soit en tant qu'ingrédients autorisés comme dans le cas des farines de légumineuses riches en lipoxygénase, soit encore en tant qu'auxiliaires de fabrication comme dans le cas de la glucose oxydase.
Ces distinctions nous semblent importantes car face aux demandes des consommateurs en faveur de produits alimentaires naturels dépourvus d'additifs exogènes, les réglementations favorisent le remplacement des additifs alimentaires par des enzymes qui entrent dans la catégorie des auxiliaires technologiques. Ces derniers étant détruits ou éliminés au cours des diverses étapes de la fabrication, n'apparaissent pas dans le produit fini à la différence des additifs dont l'emploi, pour cette raison, soulève des interrogations entraînant des réglementations plus sévères, basées sur la démonstration de leur innocuité dans les conditions où ils sont utilisés.
Quelques enzymes susceptibles d'intervenir ainsi que les réactions catalysées sont répertoriées dans le tableau 1. Nous n'avons pas retenu, sauf exception, les oxydoréductases nécessitant la présence de cofacteurs pour fonctionner parce que nous n'estimons pas que la régénération des cofacteurs puisse se réaliser aisément au sein de la pâte. En outre, nous n'avons pas mentionné l'équipement enzymatique de la levure très riche en diverses oxydoréductases mais dont la plupart sont intracellulaires.
 1. La lipoxygénase
1. La lipoxygénase
La lipoxygénase est une enzyme catalysant l'oxydation, par l'oxygène moléculaire, des acides gras polyinsaturés possédant le système de doubles liaisons non conjuguées cis-cis, 1-4 pentadiène, principalement les acides linoléique et linolénique (NICOLAS et DRAPRON, 1983 ; GARDNER, 1988 ; WHITAKER, 1991).
En prenant l’exemple de l’acide linoléique, la première étape correspond à l'élimination d'un radical hydrogène sur le carbone en position w 8 (apparition d'un radical libre). Il se produit alors une isomérisation avec formation d'un système de doubles liaisons conjuguées cis-trans, puis fixation d'un biradical oxygène en position w 6 ou w 10 pour donner après addition d'un radical hydrogène, le 13-L-hydroperoxyde ou le 9-D-hydroperoxyde.
Les hydroperoxydes formés ainsi que les radicaux libres qui apparaissent transitoirement sont des composés très réactifs. Cette réactivité explique, pour une bonne part, le rôle de la lipoxygénase en panification. L'importance de ces effets dépend de l'activité de cette enzyme dans les pâtes (résultante de la lipoxygénase endogène de la farine de blé et des lipoxygénases exogènes apportées par les farines de fève ou de soja éventuellement ajoutées), mais aussi des conditions de pétrissage.
En effet, ces dernières conditionnent l'apport d'oxygène et le renouvellement des contacts enzyme-substrat, facteurs essentiels à la manifestation de l'activité lipoxygénasique (NICOLAS et POTUS, 1994).
Oxydation des acides gras polyinsaturés
En absence de levure, la plus grande part de l'oxygène absorbé au cours du pétrissage par la pâte est utilisée pour l'oxydation des acides linoléique et linolénique sous forme libre ou de monoglycérides, les autres acides gras n'étant pas affectés (DRAPRON et BEAUX, 1969 ; GRAVELAND, 1970a ; CASTELLO et al., 1998 ; AMEILLE et al., 1999a).
Les hydroperoxydes formés par la lipoxygénase sont ensuite partiellement convertis par des réactions enzymatiques ou non, en monohydroxyacides, hydroxyépoxyacides et trihydroxyacides. Les proportions relatives de ces composés apparaissent en partie liées au rapport eau / farine. Selon GRAVELAND (1970b, 1973a et b), les monohydroxyacides sont formés préférentiellement dans les suspensions aqueuses de farine par réduction des hydroperoxydes avec oxydation de composés réducteurs tels que les thiols. En revanche, les trihydroxyacides résultant de l'hydrolyse des hydroxy-époxyacides sont présents en plus grande quantité dans les pâtes de farine.
Oxydation des groupements thiols
- Libération des lipides - Effets rhéologiques
Le pétrissage des pâtes en présence d'air provoque une oxydation des groupements thiols (TSEN et BUSHUK, 1963). Pour l'expliquer, diverses hypothèses ont été avancées, faisant notamment intervenir la cooxydation des thiols du gluten par des peroxydes lipidiques formés par la lipoxygénase (GRAVELAND et al., 1978 ; GROSCH, 1986).
Pendant la formation des pâtes en présence d'air, la proportion de lipides libres (directement extractibles par un solvant apolaire) augmente avec l'énergie du pétrissage. Selon DANIELS et al. (1970), les radicaux lipidiques intermédiaires formés par la lipoxygénase seraient capables de cooxyder les composés thiols du gluten dans un environnement hydrophobe.
Il en résulterait une inversion de la micelle lipoprotéique avec apparition de sites hydrophiles et libération de lipides. Ce phénomène, accentué par l'addition de lipoxygénase exogène (farine de soja), serait également responsable d'une amélioration des qualités rhéologiques des pâtes, se traduisant par une augmentation de leur tolérance au pétrissage et un accroissement du volume des pains.
Il faut cependant noter que les effets rhéologiques ne sont observables que pour des quantités d'énergie et des vitesses d'apport d'énergie élevées lors du pétrissage (FRAZIER et al., 1973). Ceci implique que les réactions d'oxydation des protéines du gluten probablement promues par les transferts de radicaux libres des lipides peroxydés vers les protéines du gluten ne sont notables que lorsque le renouvellement des contacts est fréquent.
Effet sur les pigments caroténoïdes
Pendant le pétrissage, la lipoxygénase capte l'oxygène de l'air, oxyde les acides gras et détruit les pigments caroténoïdes par un processus d'oxydation couplée (DANIELS et al., 1970 ; NICOLAS, 1978).
Ce phénomène, se traduisant par une décoloration des pâtes, a conduit HAAS et BOHN (1934) à déposer, il y a plus de 60 ans, une série de brevets pour l'utilisation de la farine de soja afin d'obtenir des pains à mie blanche. De nombreux auteurs ont étudié le pouvoir cooxydant des lipoxygénases de diverses origines sur des milieux modèles contenant du b-carotène ou de la crocine et le substrat naturel (l'acide linoléique) de l'enzyme (WEBER et GROSCH, 1976 ; CABIBEL et NICOLAS, 1991).
Ce pouvoir cooxydant, rapport des vitesses de décoloration et de consommation d'oxygène, varie fortement suivant les types de lipoxygénase. À activité lipoxygénasique égale, celles de type 2 (pois, fève, soja type 2,...) décolorent beaucoup plus rapidement le b-carotène que celles de type 1 (blé, soja type 1,...) (GROSCH et al., 1976 ; NICOLAS et al., 1982).
Par ailleurs, NICOLAS (1978) a montré que l'addition de farine de fève ou de lipoxygénase purifiée accroît la quantité de pigments caroténoïdes oxydés, tout comme l'augmentation de la vitesse de pétrissage.
Outre les caroténoïdes, les tocophérols sont en partie détruits par oxydation couplée sous l'action de la lipoxygénase (DRAPRON et al., 1971), alors que les vitamines B1 et B6, pourtant sensibles à l'oxydation ne le sont pas (DRAPRON et al., 1974). Selon ces auteurs, ces différences sont liées au caractère hydrophobe des caroténoïdes et des tocophérols, à l'opposé des vitamines B1 et B6.
Influence sur l'arôme du pain
Les techniques de pétrissage rapide alliées à l'addition de farine de fève provoquent une modification de l'arôme du pain (DRAPRON et al., 1974).
Il y a, en effet, une quantité 10 fois plus importante d'hexanal dans un pain obtenu en pétrissage intensifié avec 2 % de farine de fève qu'après un pétrissage normal en absence de farine de fève (ou avec une farine de fève inactivée). Cet aldéhyde, dérivé de scission des hydroperoxydes lipidiques, trouve son origine dans l'activité lipoxygénasique amenée par la farine de fève.
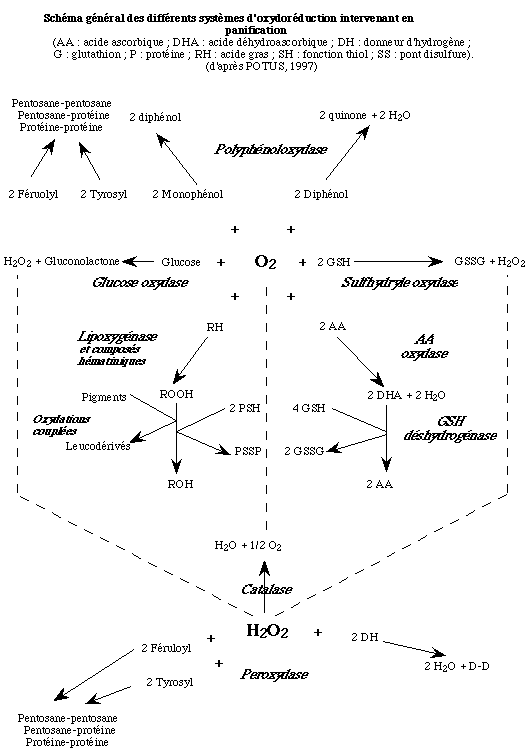
Au total, la lipoxygénase se situe au carrefour de plusieurs réactions. Cependant, il existe dans les pâtes de farine plusieurs autres oxydoréductases dont les substrats peuvent jouer le rôle d'effecteurs (activateur ou inhibiteur) vis-à-vis du système lipoxygénasique (Fig. 1) et en conséquence modifier profondément les cinétiques des réactions mises en jeu (NICOLAS, 1979 ; ICARD et FEILLET, 1997 ; DELCROS et al., 1998).
Au cours du pétrissage de la pâte boulangère interviennent des réactions de réduction conduisant à son affaiblissement par dépolymérisation des protéines, notamment si le pétrissage se prolonge. Cependant, en présence d'air, le moindre apport d'oxygène amorce des réactions d'oxydation dont l'une, inverse de la précédente, est la formation de ponts disulfures entre les protéines résultant de leur oxydation couplée par les hydroperoxydes d'acides gras formés par l'intermédiaire de la lipoxygénase, et une autre pourrait être la formation de ponts phénoliques entre protéines et arabinoxylanes par l'intermédiaire de la sulfhydryle oxydase et de la peroxydase.
Il en résulte une coexistence des réactions de polymérisation et de dépolymérisation. Il est d'usage de favoriser les premières par l'intensification du pétrissage augmentant l'apport d'oxygène ou par l'incorporation de farines de légumineuses riches en lipoxygénase mais aussi par l'emploi d'acide ascorbique, de glucose oxydase ou d'autres oxydoréductases.
L'acide ascorbique, par l'intermédiaire de l'acide ascorbique oxydase et de la glutathion déshydrogénase, fait basculer les thiols rhéologiquement actifs vers leurs formes oxydées les rendant indisponibles pour participer aux réactions de dépolymérisation. La glucose oxydase et la sulfhydryle oxydase produisent du peroxyde d'hydrogène, substrat d'une peroxydase endogène, catalysant la formation de ponts phénoliques entre macromolécules protéiques et glucidiques. En outre, la sulfhydryle oxydase oxyde les thiols peptidiques.
Mots clés : lipoxygénase, peroxydase, catalase, polyphénol oxydase, acide ascorbique oxydase, glutathion déshydrogénase, glucose oxydase, sulfhydryle oxydase.
Introduction
En technologie de panification, l'importance des phénomènes d'oxydoréduction qui se produisent au cours du pétrissage est largement reconnue, notamment en ce qui concerne le couple disulfure-thiol et ses conséquences sur les propriétés rhéologiques des pâtes (BLOKSMA et BUSHUK, 1988) ou en ce qui concerne l'oxydation des acides gras polyinsaturés et ses répercussions sur les qualités organoleptiques du pain (DRAPRON et al., 1974).
Ces réactions peuvent se produire spontanément ou être catalysées par des métaux. Cependant, la présence d'enzymes accroît fortement les vitesses de réaction tout en les orientant vers la production d'un métabolite privilégié.
Nous nous proposons de passer en revue les différentes enzymes aptes à catalyser les réactions d'oxydoréduction – comme nous l'avons fait pour celles catalysant des réactions d'hydrolyse (POTUS et al., 1996) – en insistant sur les conséquences de ces réactions sur les caractéristiques des pâtes et les qualités du pain.
Il convient toutefois de préciser que les enzymes peuvent être endogènes à la farine mais qu'elles peuvent être aussi volontairement ajoutés à la farine – au stade meunier ou boulanger – soit en tant qu'ingrédients autorisés comme dans le cas des farines de légumineuses riches en lipoxygénase, soit encore en tant qu'auxiliaires de fabrication comme dans le cas de la glucose oxydase.
Ces distinctions nous semblent importantes car face aux demandes des consommateurs en faveur de produits alimentaires naturels dépourvus d'additifs exogènes, les réglementations favorisent le remplacement des additifs alimentaires par des enzymes qui entrent dans la catégorie des auxiliaires technologiques. Ces derniers étant détruits ou éliminés au cours des diverses étapes de la fabrication, n'apparaissent pas dans le produit fini à la différence des additifs dont l'emploi, pour cette raison, soulève des interrogations entraînant des réglementations plus sévères, basées sur la démonstration de leur innocuité dans les conditions où ils sont utilisés.
Quelques enzymes susceptibles d'intervenir ainsi que les réactions catalysées sont répertoriées dans le tableau 1. Nous n'avons pas retenu, sauf exception, les oxydoréductases nécessitant la présence de cofacteurs pour fonctionner parce que nous n'estimons pas que la régénération des cofacteurs puisse se réaliser aisément au sein de la pâte. En outre, nous n'avons pas mentionné l'équipement enzymatique de la levure très riche en diverses oxydoréductases mais dont la plupart sont intracellulaires.

La lipoxygénase est une enzyme catalysant l'oxydation, par l'oxygène moléculaire, des acides gras polyinsaturés possédant le système de doubles liaisons non conjuguées cis-cis, 1-4 pentadiène, principalement les acides linoléique et linolénique (NICOLAS et DRAPRON, 1983 ; GARDNER, 1988 ; WHITAKER, 1991).
En prenant l’exemple de l’acide linoléique, la première étape correspond à l'élimination d'un radical hydrogène sur le carbone en position w 8 (apparition d'un radical libre). Il se produit alors une isomérisation avec formation d'un système de doubles liaisons conjuguées cis-trans, puis fixation d'un biradical oxygène en position w 6 ou w 10 pour donner après addition d'un radical hydrogène, le 13-L-hydroperoxyde ou le 9-D-hydroperoxyde.
Les hydroperoxydes formés ainsi que les radicaux libres qui apparaissent transitoirement sont des composés très réactifs. Cette réactivité explique, pour une bonne part, le rôle de la lipoxygénase en panification. L'importance de ces effets dépend de l'activité de cette enzyme dans les pâtes (résultante de la lipoxygénase endogène de la farine de blé et des lipoxygénases exogènes apportées par les farines de fève ou de soja éventuellement ajoutées), mais aussi des conditions de pétrissage.
En effet, ces dernières conditionnent l'apport d'oxygène et le renouvellement des contacts enzyme-substrat, facteurs essentiels à la manifestation de l'activité lipoxygénasique (NICOLAS et POTUS, 1994).
Oxydation des acides gras polyinsaturés
En absence de levure, la plus grande part de l'oxygène absorbé au cours du pétrissage par la pâte est utilisée pour l'oxydation des acides linoléique et linolénique sous forme libre ou de monoglycérides, les autres acides gras n'étant pas affectés (DRAPRON et BEAUX, 1969 ; GRAVELAND, 1970a ; CASTELLO et al., 1998 ; AMEILLE et al., 1999a).
Les hydroperoxydes formés par la lipoxygénase sont ensuite partiellement convertis par des réactions enzymatiques ou non, en monohydroxyacides, hydroxyépoxyacides et trihydroxyacides. Les proportions relatives de ces composés apparaissent en partie liées au rapport eau / farine. Selon GRAVELAND (1970b, 1973a et b), les monohydroxyacides sont formés préférentiellement dans les suspensions aqueuses de farine par réduction des hydroperoxydes avec oxydation de composés réducteurs tels que les thiols. En revanche, les trihydroxyacides résultant de l'hydrolyse des hydroxy-époxyacides sont présents en plus grande quantité dans les pâtes de farine.
Oxydation des groupements thiols
- Libération des lipides - Effets rhéologiques
Le pétrissage des pâtes en présence d'air provoque une oxydation des groupements thiols (TSEN et BUSHUK, 1963). Pour l'expliquer, diverses hypothèses ont été avancées, faisant notamment intervenir la cooxydation des thiols du gluten par des peroxydes lipidiques formés par la lipoxygénase (GRAVELAND et al., 1978 ; GROSCH, 1986).
Pendant la formation des pâtes en présence d'air, la proportion de lipides libres (directement extractibles par un solvant apolaire) augmente avec l'énergie du pétrissage. Selon DANIELS et al. (1970), les radicaux lipidiques intermédiaires formés par la lipoxygénase seraient capables de cooxyder les composés thiols du gluten dans un environnement hydrophobe.
Il en résulterait une inversion de la micelle lipoprotéique avec apparition de sites hydrophiles et libération de lipides. Ce phénomène, accentué par l'addition de lipoxygénase exogène (farine de soja), serait également responsable d'une amélioration des qualités rhéologiques des pâtes, se traduisant par une augmentation de leur tolérance au pétrissage et un accroissement du volume des pains.
Il faut cependant noter que les effets rhéologiques ne sont observables que pour des quantités d'énergie et des vitesses d'apport d'énergie élevées lors du pétrissage (FRAZIER et al., 1973). Ceci implique que les réactions d'oxydation des protéines du gluten probablement promues par les transferts de radicaux libres des lipides peroxydés vers les protéines du gluten ne sont notables que lorsque le renouvellement des contacts est fréquent.
Effet sur les pigments caroténoïdes
Pendant le pétrissage, la lipoxygénase capte l'oxygène de l'air, oxyde les acides gras et détruit les pigments caroténoïdes par un processus d'oxydation couplée (DANIELS et al., 1970 ; NICOLAS, 1978).
Ce phénomène, se traduisant par une décoloration des pâtes, a conduit HAAS et BOHN (1934) à déposer, il y a plus de 60 ans, une série de brevets pour l'utilisation de la farine de soja afin d'obtenir des pains à mie blanche. De nombreux auteurs ont étudié le pouvoir cooxydant des lipoxygénases de diverses origines sur des milieux modèles contenant du b-carotène ou de la crocine et le substrat naturel (l'acide linoléique) de l'enzyme (WEBER et GROSCH, 1976 ; CABIBEL et NICOLAS, 1991).
Ce pouvoir cooxydant, rapport des vitesses de décoloration et de consommation d'oxygène, varie fortement suivant les types de lipoxygénase. À activité lipoxygénasique égale, celles de type 2 (pois, fève, soja type 2,...) décolorent beaucoup plus rapidement le b-carotène que celles de type 1 (blé, soja type 1,...) (GROSCH et al., 1976 ; NICOLAS et al., 1982).
Par ailleurs, NICOLAS (1978) a montré que l'addition de farine de fève ou de lipoxygénase purifiée accroît la quantité de pigments caroténoïdes oxydés, tout comme l'augmentation de la vitesse de pétrissage.
Outre les caroténoïdes, les tocophérols sont en partie détruits par oxydation couplée sous l'action de la lipoxygénase (DRAPRON et al., 1971), alors que les vitamines B1 et B6, pourtant sensibles à l'oxydation ne le sont pas (DRAPRON et al., 1974). Selon ces auteurs, ces différences sont liées au caractère hydrophobe des caroténoïdes et des tocophérols, à l'opposé des vitamines B1 et B6.
Influence sur l'arôme du pain
Les techniques de pétrissage rapide alliées à l'addition de farine de fève provoquent une modification de l'arôme du pain (DRAPRON et al., 1974).
Il y a, en effet, une quantité 10 fois plus importante d'hexanal dans un pain obtenu en pétrissage intensifié avec 2 % de farine de fève qu'après un pétrissage normal en absence de farine de fève (ou avec une farine de fève inactivée). Cet aldéhyde, dérivé de scission des hydroperoxydes lipidiques, trouve son origine dans l'activité lipoxygénasique amenée par la farine de fève.
Au total, la lipoxygénase se situe au carrefour de plusieurs réactions. Cependant, il existe dans les pâtes de farine plusieurs autres oxydoréductases dont les substrats peuvent jouer le rôle d'effecteurs (activateur ou inhibiteur) vis-à-vis du système lipoxygénasique (Fig. 1) et en conséquence modifier profondément les cinétiques des réactions mises en jeu (NICOLAS, 1979 ; ICARD et FEILLET, 1997 ; DELCROS et al., 1998).
2. La peroxydase
Plusieurs isoenzymes ont été purifiées à partir du blé dur (JEANJEAN et al., 1975 ; IORI et al., 1995) et du germe de blé tendre (ZMRHAL et MACHACKOVA, 1978 ; BILLAUD et al., 1999).
La peroxydase est potentiellement capable de catalyser quatre types de réactions, peroxydative, catalasique, oxydative et hydroxylante (ROBINSON, 1991). L'équation générale de la réaction peroxydasique s'écrit :
ROOH + DH2 D + H2O + ROH
(ou ROOH + 2 DH D-D + H2O + ROH)
Il s'agit d'une réaction enzymatique à deux substrats, dans laquelle la peroxydase possède une étroite spécificité vis-à-vis de l'accepteur d'électron ROOH (avec R = H, CH3 ou C2H5) et une spécificité beaucoup plus large vis-à-vis du donneur d'hydrogène DH2 (ou DH) dont la nature est très variée (phénols, amines aromatiques, thiols et en particulier le glutathion, acides organiques dont l'acide ascorbique, etc.). La réaction a lieu selon un mécanisme ping-pong (DUNFORD et STILLMAN, 1976 ; RICHARD et NICOLAS, 1989).
Les peroxydases sont aussi capables, en présence d'oxygène, de catalyser l'oxydation des acides gras insaturés, par l'intermédiaire de leur groupement hématinique. Elles sont donc susceptibles de produire des effets similaires à ceux de la lipoxygénase mais de façon moins marquée en raison de leur pouvoir catalytique moins élevé (TAPPEL, 1961) ; par exemple, il a été montré que l'addition de peroxydase de raifort augmente la vitesse de destruction des pigments caroténoïdes au cours du pétrissage (NICOLAS, 1978).
De plus, selon des études réalisées in vitro, la peroxydase est susceptible de créer des liaisons covalentes provoquant un renforcement de la cohésion de gels protéiques ou glucidiques. Ainsi, MATHEIS et WHITAKER (1984) présentent deux voies de polymérisation des protéines catalysées par la peroxydase :
– en présence d'un donneur d'hydrogène de faible masse molaire (phénol ou diamine), de peroxyde d'hydrogène et de protéines, la peroxydase provoque la formation de radicaux libres ou de quinones réagissant avec les fonctions amines, thiols, phénols, indoles ou imidazoles des protéines.
L'électrophorèse des produits de réaction révèle la formation de nouvelles bandes correspondant à des dimères, des trimères voire des oligomères de protéines. Ainsi, en ajoutant de la cystéine ou du glutathion à un mélange peroxydase / H2O2 / catéchol, MATHEIS et WHITAKER (1984) ont trouvé des produits de réactions contenant des groupes aminés et phénoliques ainsi que de la cystine et du glutathion oxydé ;
– en absence d'un tel type de donneur, les protéines riches en résidus tyrosine peuvent elles-mêmes servir de substrat pour le système peroxydase / H2O2 et se polymériser par suite de la formation de ponts phénoliques intermoléculaires.
KIEFFER et al. (1981) ont observé une amélioration des propriétés rhéologiques des pâtes de farine de faible valeur boulangère en présence de peroxydase de raifort, de peroxyde d'hydrogène et de catéchol. Ils l'ont attribuée à l'oxydation des groupements thiols des protéines en ponts disulfures. De même, selon VAN OORT et al. (1997), l'addition de pêroxydase de soja permet d'améliorer les propriétés rhéologiques des pâtes.
La peroxydase apparaît donc susceptible de modifier les propriétés rhéologiques de la pâte par son action sur les protéines ainsi que cela avait été proposé par EVANS et MECHAM (1971).
Une autre voie d'action de la peroxydase concerne son effet sur les pentosanes hydrosolubles présents dans les pâtes. Ces composés peuvent former des gels viscoélastiques sous l'action d'oxydants tels que les radicaux libres produits par la peroxydase en présence de peroxyde d'hydrogène (HOSENEY et FAUBION, 1981). L'acide férulique inséré dans les chaînes de pentosanes est impliqué dans le phénomène selon trois mécanismes possibles mais non exclusifs l'un de l'autre :
– dans le premier, il y a formation d'un pont phénolique par oxydation de deux acides féruliques (Fig. 2A), provoquant une réticulation covalente entre deux molécules d'arabinoxylanes (NEUKOM et MARKWALDER, 1978) ;
– dans le deuxième, la fixation de l'acide férulique s'effectue sur un noyau phénolique porté par la chaîne latérale d'une tyrosine incorporée dans une protéine ; il s'ensuit la formation d'un pont phénolique conduisant à un polymère mixte arabinoxylane-protéine (Fig. 2B) ;
– dans le troisième, il y a fixation d'un groupement thiol cystéinyl sur la double liaison activée de l'acide férulique, conduisant également à un polymère arabinoxylane-protéine (HOSENEY et FAUBION, 1981) (Fig. 3).
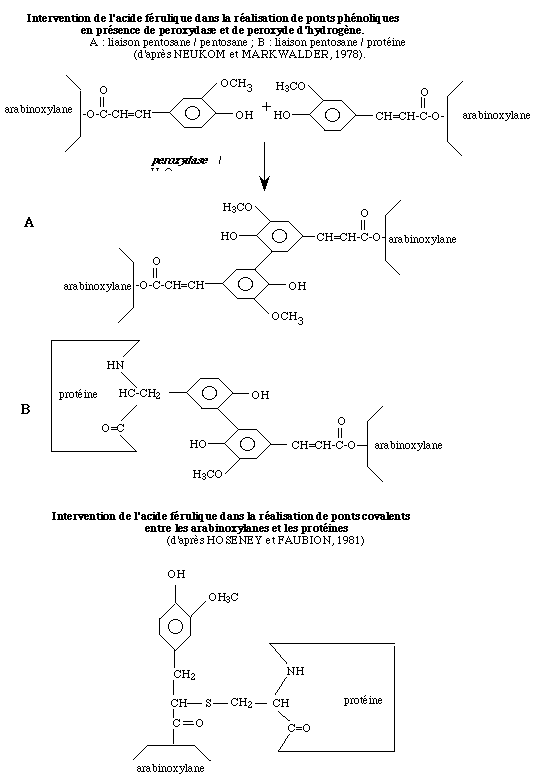
Notons que ces deux derniers mécanismes sont remis en cause par les résultats obtenus par FIGUEROA-ESPINOZA et al. (1998). Ces auteurs montrent que la réticulation des pentosanes catalysée par la peroxydase est ralentie en présence de thiols. Ce ralentissement est dû à la formation de ponts disulfures sans fixation de thiol sur l'acide férulique.
Enfin, la peroxydase renforce l'action de la lipoxygénase en détruisant le peroxyde d'hydrogène qui est son inhibiteur.
Par ces divers mécanismes, la peroxydase en présence d'eau oxygénée est capable de jouer un rôle important dans le renforcement de la cohésion des pâtes de farine via la réticulation des protéines et / ou celle des pentosanes ainsi que via la coréticulation de ces deux polymères.
Notons par ailleurs que CHERDKIATGUMCHAI et GRANT (1986) ont observé qu'en présence d'acide ascorbique et d'eau oxygénée, la peroxydase oxyde rapidement l'acide ascorbique en l'utilisant comme donneur d'hydrogène.
Cependant, toutes ces actions de la peroxydase supposent la présence de peroxyde d'hydrogène au cours du pétrissage ce qui amène à se poser la question, non résolue à notre connaissance, de la fonctionnalité de cette enzyme au cours de ce processus.
3. La catalase
Si l'on excepte les travaux de IRVINE et al., (1954), HONOLD et STAHMAN (1968), KRUGER (1977) et GARCIA et al. (1999), les activités catalasiques du blé ont fait l'objet d'un nombre restreint d'études.
La catalase est une hémoprotéine dont le groupement prosthétique est constitué par une porphyrine à fer.
Elle possède deux types d'activité, catalasique et peroxydasique (WHITAKER, 1985). Seule la première est observée dans les conditions habituelles et correspond à la dismutation du peroxyde d'hydrogène en eau et oxygène moléculaire.
Dans ce cas, une molécule de peroxyde d'hydrogène joue le rôle de donneur et une autre, celui d'accepteur d'électrons, selon le mécanisme suivant :
Catalase (FeIII) + H2O2 Composé I + H2O
Composé I + H2O2 Catalase (FeIII) + O2 + H2O
Le composé I est un puissant agent oxydant.
L'activité de type peroxydasique n'apparaît que pour de faibles concentrations en peroxyde d'hydrogène. La nature du donneur d'hydrogène est variable (phénols, alcools, acides formique et ascorbique). La catalase agit alors comme une peroxydase avec des intermédiaires réactionnels et des caractéristiques spectrales identiques à cette dernière (WHITAKER, 1985).
Très peu d'études ont été consacrées à l'intervention de la catalase en panification. Seuls HAWTHORN et TODD (1955) ont montré que l'ajout de cette enzyme à la pâte provoque une accélération de la destruction des pigments caroténoïdes au cours du pétrissage.
Comme pour la peroxydase, cet effet peut s'expliquer par la présence du groupement hématinique, catalyseur de l'oxydation des lipides (NICOLAS, 1979). Ce pouvoir oxydant a conduit certains auteurs à supposer une action bénéfique de la catalase sur les propriétés rhéologiques des pâtes par analogie avec l'effet de la lipoxygénase (IRVINE et al., 1954 ; HONOLD et STAHMANN, 1968).
De plus, en détruisant le peroxyde d'hydrogène inhibiteur de la lipoxygénase, cette enzyme, de la même façon que la peroxydase, favorise l'action de la lipoxygénase. En outre, elle rétrocède de l'oxygène à la lipoxygénase (Fig. 1).
Cependant, comme dans le cas de la peroxydase, il convient de se poser la question de la fonctionnalité de la catalase in situ au cours du pétrissage. Celle-ci suppose que son substrat, le peroxyde d'hydrogène, soit effectivement présent dans la pâte.
4. Les polyphénoloxydases
Le terme " polyphénoloxydase " pris au sens large correspond à plusieurs groupes d'enzymes. Chez les végétaux, en premier lieu, on y trouve les catéchol oxydases (EC 1.10.3.1) comprenant une activité monophénolasique (crésolase) et une activité ortho diphénolasique (catécholase) ; l'activité crésolase est rarement présente, elle est en particulier difficilement détectable dans le blé.
Le deuxième groupe est constitué des laccases (EC 1.10.3.2) qui ont une activité ortho diphénolasique et une activité para diphénolasique, elles n'existent pas dans les céréales. À ces deux groupes s'ajoute un troisième (EC 1.14.18.1) qui est une monophénol mono-oxygénase (tyrosinase) équivalente à la catéchol oxydase (EC 1.10.3.1) mais avec une activité crésolasique toujours présente.
Toutes sont responsables du brunissement enzymatique, souvent préjudiciable à l'aspect du végétal ou de ses produits de transformation.
Le rôle des polyphénoloxydases en technologie céréalière a tout d'abord été confiné à une intervention sur la couleur. Ainsi, dès 1972, KOBREHEL et al. ont observé une corrélation entre l'indice de brun des semoules de blé dur et leurs activités polyphénoloxydasiques et peroxydasiques. Puis en 1976, KUNINORI et al. ont mis en évidence un raffermissement des pâtes de farine lorsqu'elles sont supplémentées par un extrait de champignon.
Selon ces auteurs, la polyphénoloxydase de champignon serait responsable de cet effet selon deux mécanismes possibles similaires à ceux proposés pour la peroxydase en présence de peroxyde d'hydrogène. Le premier correspond à l'oxydation de l'acide férulique conduisant à la réticulation des pentosanes (FAUSCH et al., 1963 ; GEISMANN et NEUKOM, 1973 ; NEUKOM et MARKWALDER, 1978) et le second à l'oxydation des fonctions phénol de la tyrosine et thiol de la cystéine provoquant la polymérisation des protéines.
Par la suite, KUNINORI et al. (1978) et NISHIYAMA et al. (1979) ont montré sur un milieu modèle que l'action de la polyphénoloxydase au cours du pétrissage conduit à l'oxydation des thiols ainsi qu'à la formation de composés d'addition entre les thiols et les produits d'oxydation de la tyrosine.
Récemment, FIGUEROA-ESPINOZA et ROUAU (1998) et FIGUEROA-ESPINOZA et al. (1998) ont montré que la laccase extraite de Pycnoporus cinnabarinus était capable de provoquer la réticulation oxydative des pentosanes et la formation de ponts disulfures à partir de cystéine et de glutathion (en présence d'acide férulique libre ou estérifié).
De plus, les polyphénoloxydases favorisent indirectement l'action de la lipoxygénase en catalysant l'oxydation des phénols qui, par leurs propriétés antioxygènes, sont des inhibiteurs de cette enzyme (NICOLAS et DRAPRON, 1977). Cependant, elles entrent en compétition avec la lipoxygénase pour l'utilisation de l'oxygène (Fig. 1).
5. L'acide ascorbique oxydase et la glutathion déshydrogénase
La farine contient une acide ascorbique oxydase, partiellement purifiée par GRANT et SOOD en 1980 et PFEILSTICKER et ROEUNG en 1980 et 1982. Cependant, il semblerait d'après CHERDKIATGUMCHAI et GRANT (1986) et GRANT (1987) qu'une fraction non négligeable de l'acide ascorbique puisse être oxydée en acide déhydroascorbique par les hydroperoxydes d'acides gras générés par la lipoxygénase, voire par la peroxydase.
Quoiqu'il en soit, l'acide ascorbique oxydase est susceptible d'influencer l'action de la lipoxygénase, directement en entrant en compétition avec elle pour l'utilisation de l'oxygène et de façon indirecte en favorisant la disparition de l'acide ascorbique qui est inhibiteur de la lipoxygénase (WALSH et al., 1970) (Fig. 1).
Par ailleurs, il existe également dans la farine une déhydroascorbate réductase ou glutathion déshydrogénase capable de réduire l'acide déhydroascorbique en acide ascorbique, en présence de glutathion réduit (GSH), lequel est oxydé (GSSG) avec formation d'un pont disulfure (WALTHER et GROSCH, 1987 ; SARWIN et al., 1993 ; KAÏD et al., 1997) (Fig. 1).
Bien que la cystéine ne soit pas substrat de l'enzyme, elle est oxydée en présence de glutathion pour donner un mélange de cystine (CSSC) et de disulfure mixte cystéine-glutathion (CSSG) (KAÏD, 1998).
L'acide D-thréo déhydroascorbique n'est pas non plus substrat tandis que les acides D- et L-érythro déhydroascorbique réagissent moins vite que l'acide L-thréo déhydroascorbique (GROSCH, 1986 ; KAÏD et al., 1997 ; GROSCH et WIESER, 1999).
C'est la présence conjointe des deux enzymes constituant le système acide ascorbique oxydase / glutathion déshydrogénase qui – d'après MAIR et GROSCH (1979), KAÏD, (1998) et GROSCH et WIESER, (1999) – serait responsable de l'effet améliorant de l'acide ascorbique en rendant le glutathion et la cystéine indisponibles pour participer aux échanges thiols / disulfures avec les protéines du gluten.
6. La glucose oxydase et la sulfhydryle oxydase
La glucose oxydase naturellement absente de la farine de blé catalyse l'oxydation par l'oxygène du b-D-glucose en d-D-gluconolactone avec formation de peroxyde d'hydrogène.
La glucose oxydase d'Aspergillus niger est une enzyme fréquemment citée pour remplacer les oxydants chimiques, tels que l'acide ascorbique ou le bromate de potassium, en panification (HAARASILTA et al., 1989 ; HAARASILTA et VAEISAENEN, 1989 ; WIKSTRÖM et ELIASSON, 1998 ; VEMULAPALLI et al., 1998).
En effet, devant l'exigence des consommateurs en faveur d'aliments dépourvus d'additifs, plusieurs fabricants d'enzymes préconisent de remplacer les additifs à action oxydante par des oxydoréductases telles que la glucose oxydase (FAISY et NEYRENEUF, 1996 ; GÉLINAS et al., 1988) et l'hexose oxydase (EC 1.1.3.5) (POULSEN et BAKHSTRUP, 1998).
Il est clair que l'incorporation à la farine de glucose oxydase modifie l'importance relative des systèmes enzymatiques consommant l'oxygène et le peroxyde d'hydrogène. Elle devrait en particulier réduire l'importance de l'activité lipoxygénasique selon deux mécanismes : en entrant en compétition pour l'utilisation de l'oxygène et en formant du peroxyde d'hydrogène inhibiteur de la lipoxygénase (Fig. 1) (RAKOTOZAFY et al., 1999).
Par ailleurs, la production d'eau oxygénée permet d'activer la peroxydase et la catalase. L'effet améliorant de la glucose oxydase est très probablement dû à l’activation de la peroxydase conduisant à une réticulation des macromolécules glucidiques et protéiques par suite de l’oxydation des composés phénoliques (AMEILLE et al., 1999b).
La sulfhydryle oxydase est une métalloprotéine qui a été purifiée à partir du lait (SWAISGOOD, 1980). POTUS (1997) a apporté plusieurs arguments en faveur de l'existence d'une activité sulfhydryle oxydase au sein de la pâte boulangère. Elle provoque l'oxydation du glutathion tout en produisant de l'eau oxygénée. Ces deux actions simultanées, la disparition de thiols avec formation de ponts disulfures ainsi que l'activation de la peroxydase pourrait rendre compte de l'effet améliorant de l'addition d'extraits d'origine fongique de cette enzyme sur la consistance des pâtes (MUTSAERS, 1994).
Bien que KAUFMAN et FENNEMA (1987) n'aient pas réussi à mettre en évidence une oxydation accrue de thiols ou un effet rhéologique dans des pâtes additionnées de sulfhydryle oxydase ou du mélange sulfhydryle oxydase + peroxydase, plusieurs brevets d'utilisation de cette enzyme comme améliorant de panification ont été déposés (HAARISILTA et al., 1991 ; SOUPPE, 1996).
7. La superoxyde dismutase
Présente dans la farine de blé et isolée à partir du germe par BEAUCHAMP et FRIDOVICH (1973) puis par JAASKA (1982), cette enzyme transforme l'anion superoxyde en peroxyde d'hydrogène et en oxygène moléculaire. Son rôle technologique est actuellement inconnu mais elle pourrait approvisionner en substrat la catalase et la peroxydase. Récemment, NAKAMURA et KURATA (1997) ont suggéré qu’elle pourrait être activée en présence d’acide ascorbique.
8. La thiorédoxine réductase
La thiorédoxine peut être réversiblement oxydée ou réduite par une thiorédoxine réductase (EC 1.6.4.5) et oscille entre les formes dithiol et disulfure. Cette enzyme serait susceptible de favoriser les réactions d'échanges de groupes disulfures entre les protéines du gluten (VIANEY-LIAUD et al., 1994). Il s'agit cependant d'une enzyme nécessitant le NADPH,H+ comme cofacteur, et on peut s'interroger sur les possibilités de régénération de ce cofacteur in situ dans les pâtes.
Conclusions
À l'issue de cette revue concernant les enzymes d'oxydoréduction intervenant ou susceptibles d'intervenir au cours du pétrissage, il apparaît d'étroites relations entre les différentes réactions pouvant conduire selon les cas à des synergies ou à des antagonismes dans les effets observés (Fig. 1). En effet, les réactions d'oxydoréduction qui se produisent au cours du pétrissage sont interdépendantes.
Elles partagent des substrats communs, par exemple l'oxygène ou le peroxyde d'hydrogène ; ainsi, quasiment toutes les oxydoréductases peuvent intervenir à des degrés divers, directement ou indirectement, sur la consommation d'oxygène ou l'oxydation des lipides ou encore celle des thiols et des phénols. De plus, elles génèrent des produits susceptibles d'activer ou d'inhiber d'autres oxydoréductases, c'est le cas par exemple du peroxyde d'hydrogène, puissant inhibiteur de la lipoxygénase, formé en présence de glucose oxydase ou de sulfhydryle oxydase.
En outre, il convient de prendre en compte les synergies existant entre les réactions d’hydrolyse et d’oxydoréduction : les premières alimentent les secondes en substrats : tel est le cas des associations lipase / lipoxygénase (CASTELLO et al., 1998 et 1999 ; GÉLINAS et al., 1998), amylase / glucose oxydase ou encore arabinoxylanases / polyphénoloxydases.
Merci pour ce dossier à Jacques POTUS(1)(*) , Christine GALEY(2), Caroline VIGNAUD(1),
Rebeca GARCIA(1), Annie POIFFAIT(1) et Jacques NICOLAS(1)
(1) Chaire de biochimie industrielle et agro-alimentaire. Conservatoire National des Arts et Métiers. 292 rue Saint-Martin, 75141 Paris Cedex 03, France.
(2) Société Scientifique d'Hygiène Alimentaire. Institut Supérieur de l'Alimentation.
16 rue de l'Estrapade, 75005 Paris, France.









