Les hydrolases en panification
INTRODUCTION
Du début du pétrissage jusqu'aux premiers stades de la cuisson des pâtons, de nombreux systèmes enzymatiques présents initialement dans la farine ou la levure jouent un rôle primordial sur l'aptitude de la pâte à fournir un produit possédant les qualités organoleptiques caractéristiques du pain.
La compréhension de l'effet de ces systèmes enzymatiques a conduit le technologue à optimiser leur action par l'addition au stade meunier ou boulanger d'enzymes exogènes en vue d'aboutir à une meilleure régularité de la qualité du produit fini en gommant les fluctuations du bagage enzymatique des farines. Diverses hydrolases sont aujourd'hui largement utilisées dans ce but. Cet article se propose de faire le point sur l'état actuel des connaissances concernant leurs modalités d'action et les effets qui en résultent.
Il convient de faire remarquer dès à présent que la pâte constitue un milieu semi-rigide dans lequel les activités enzymatiques sont restreintes par des contraintes d'ordre diffusionnel. Celles-ci sont sous la dépendance de deux paramètres essentiels : la teneur en eau et l'intensité du travail mécanique réalisé au cours du pétrissage ; une augmentation de l'hydratation et de l'énergie apportée favorise le renouvellement des rencontres enzymes-substrats.
Quoiqu'il en soit, la teneur en eau de la pâte à pain reste limitée et les modalités d'action des enzymes peuvent différer largement de celles que l'on observe dans des solutions aqueuses diluées, il faut donc se garder d'extrapoler directement aux pâtes les résultats obtenus en solution.
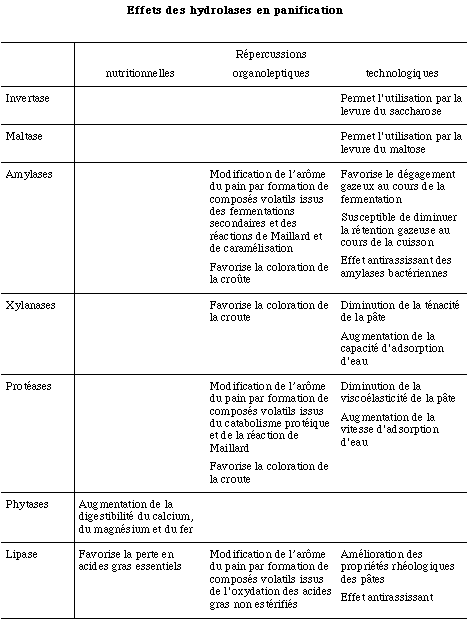
Dans la suite de cet article, nous passerons en revue les différentes classes d'hydrolases impliquées (Tableau 1) tout en décrivant les réactions catalysées et leurs conséquences sur les propriétés des pâtes et les qualités organoleptiques et nutritionnelles des produits de cuisson (Tableau 2).

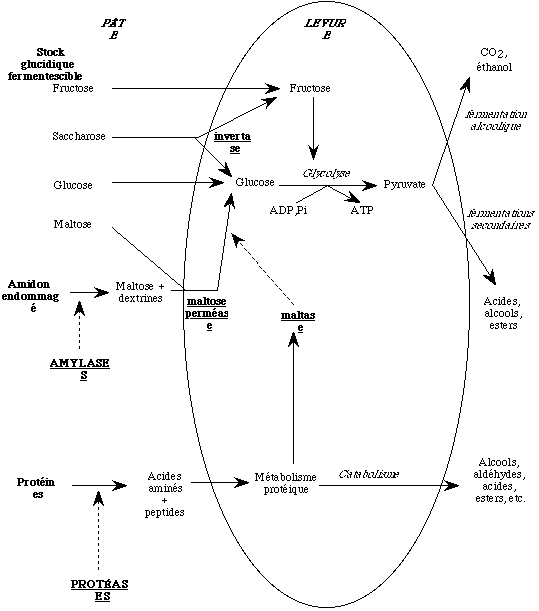
Les amylases sont un des plus importants systèmes enzymatiques en technologie de la panification, puisqu'elles fournissent les sucres nécessaires à la fermentation ainsi qu'aux réactions de brunissement de Maillard et de caramélisation se produisant lors de la cuisson. Cependant, il existe un seuil d'activité amylolytique au-delà duquel la pâte acquiert un caractère collant et la croûte une coloration excessive. Plusieurs revues résument leurs propriétés et leurs rôles en panification (DRAPRON et GODON, 1987 ; KRUGER et LINEBACK, 1987 ; VAN DAM et HILLE, 1993).
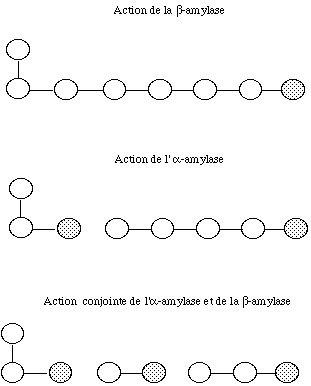
Les a-amylases (EC 3.2.1.1) sont des endoenzymes capables de rompre, uniquement et tout à fait au hasard, les liaisons D-glucosidiques a-(1Æ4) des constituants de l'amidon endommagé ou gélatinisé mais leur action s'arrête au voisinage des liaisons interchaînes a-(1Æ6). Elles libèrent des fragments allant d'une unité glucose à plusieurs dizaines qui correspondent alors à des a-dextrines.
La ß-amylase (EC 3.2.1.2) est une exoenzyme qui hydrolyse alternativement les liaisons a-(1Æ4) D-glucosidiques de l'amidon à partir des extrémités non réductrices des chaînes en libérant du ß-maltose. Son action s'arrête au voisinage des liaisons interchaînes a-(1Æ6). Les chaînes linéaires d'amylose sont entièrement hydrolysées en maltose lorsqu'elles sont constituées d'un nombre pair d'unités glucose ; une petite quantité de glucose est libéré lorsque le nombre d'unités glucose est impair. L'amylopectine n'est que partiellement dégradée en donnant du maltose et des b-dextrines limites.
Les activités a et b-amylasiques qui ne sont pas indépendantes entre elles ; l'action de l'a-amylase favorise celle de la b-amylase puisqu'elle crée à partir de l'amidon de nouvelles extrémités non réductrices qui sont reconnues comme substrat par la b-amylase (Figure 1) ; en conséquence, seules les activités a-amylasiques des farines de blé sont controlées de façon courante et éventuellement corrigées.
La teneur en sucres directement fermentescibles de la farine de blé, glucose et fructose, est insuffisante pour subvenir aux besoins énergétiques de la levure pendant toute la durée de la fermentation. En conséquence, ce sont les sucres simples résultant d'une hydrolyse enzymatique qui sont les substrats privilégiés de la fermentation panaire (Figure 2).
Ces sucres sont générés soit à partir du saccharose par l'invertase (EC 3.2.1.26) de la levure, soit à partir de l'amidon par les a et les ß-amylases présentes dans la farine et par la maltase (EC 3.2.1.20) synthétisée après induction par la levure (Tableau 1).
Or, d'une part, l'invertase de la levure est extrèmement active conduisant à une disparition quasi-totale du saccharose dès le début du pétrissage (POTUS et al. 1994) et d'autre part, l'activité des enzymes de la levure permettant d'utiliser le maltose (maltose perméase et maltase) est suffisante pour subvenir aux besoins de la cellule pendant toute la durée de la fermentation (Tableau 2).
En conséquence, la fermentation n'est limitée que par la vitesse de formation du maltose. Cette dernière dépend de plusieurs paramètres :
— l'activité a-amylasique ;
— l'état de surface du granule d'amidon, seul l'amidon contenu dans les granules endommagés mécaniquement lors de la phase de mouture peut être substrat des amylases à la température à laquelle se déroulent le pétrissage et la fermentation ;
— l'intensité du travail mécanique réalisé au cours du pétrissage qui favorise la vitesse de renouvellement des contacts amidon-amylases (POTUS et al. 1994).
Une concentration insuffisante en maltose dans la pâte peut limiter l'ensemble les fermentations — alcoolique ou secondaires — et conduire à des pains peu levés dont l'arôme de la mie est peu développé. En revanche, un excès d'activité amylolytique peut avoir des conséquences négatives sur la rhéologie des pâtes en augmentant leur collant et leur porosité tout en affaiblissant leur consistance.
Dès le début de la cuisson, la vitesse des réactions biochimiques croît jusqu'à atteindre un optimum. De plus, l'évolution de la structure des substrats, due à la fragilisation des liaisons hydrogène provoquée par l'augmentation de température, accélère les réactions enzymatiques. Ainsi, on constate qu'entre la gélatinisation de l'amidon et la dénaturation thermique des amylases, il existe un intervalle de temps de quelques secondes pour les b-amylases et de quelques minutes pour les a-amylases endogènes ou fongiques. Dans ce court laps de temps, la production de maltose et de dextrines est maximale.
Il faut distinguer, quant à ses conséquences sur le volume du pain, l'amylolyse se déroulant à température ordinaire à partir de l'amidon granulaire pendant la fermentation, de celle ayant lieu au début de la cuisson à partir d'amidon en cours de gélatinisation.
Dans le premier cas, une activité amylolytique importante est nécessaire pour la production de gaz carbonique et, par conséquent, pour l'accroissement du volume du pâton; dans le second cas, une amylolyse excessive augmente le collant de la mie et la porosité de la pâte, donc diminue la rétention gazeuse et, en définitive, le volume du pain (Tableau 2). Par conséquent, il est nécessaire, pour corriger une farine hypoamylasique, de prendre en compte la température d'inactivation de l'enzyme ajoutée :
— si elle est peu élevée, comme dans le cas de l'amylase fongique, un léger surdosage sera sans conséquence notable, l'action principale ayant lieu pendant la fermentation et non pendant la cuisson ;
— si elle est élevée, comme dans le cas de l'amylase de malt et plus encore dans le cas de l'a-amylase bactérienne, l'activité maximale de celle ci étant prolongée pendant la cuisson, la quantité de dextrines formées peut être importante et le volume du pain réduit.
Les amylases thermorésistantes devront être utilisées avec précaution et dans un but bien particulier, par exemple pour limiter la vitesse de rassissement du pain en hydrolysant partiellement les zones amorphes de l'amidon rétrogradé (Figure 4) (SENTI et DIMMLER, 1970).
L'emploi de pullalanase ou enzyme débranchante (EC 3.2.1.41) — capable d'hydrolyser les liaisons a-(1Æ 6) D-glucosidiques — a aussi été suggéré pour freiner le rassissement du pain (HEBEDA et al.,1990).
Elles sont citées ici pour mémoire. Le lecteur est prié de se reporter à l'article de X. ROUAU dans ce même numéro d'Industries des Céréales pour une revue d'ensemble sur ce sujet.
Les protéases (EC 3.4.21) que l'on trouve dans la pâte peuvent provenir de la farine, de la levure, du malt, ou encore de préparations a-amylasiques d'origine fongique ou bactérienne.
Les activités protéolytiques sont ainsi d'origines diverses et il est difficile de les différencier quant à leurs modes d'action et leurs conséquences sur la structure des protéines.
La germination peut considérablement augmenter les activités protéolytiques des grains et, par conséquent, de la farine. Par ailleurs, les levures contiennent des protéases endocellulaires qui peuvent être libérées lors d'une cytolyse.
De plus, certaines des protéases de la farine pourraient être d'origine fongique et bactérienne. Enfin, certains insectes comme les punaises, sont susceptibles d'introduire dans le grain de fortes activités protéolytiques mais ce risque est très limité en France tout du moins.
Les protéases endogènes de la farine sont multiples. Certaines sont du type papaïne parce qu'elles sont sensibles à la présence d'oxydants ou de réducteurs, elles agissent comme endoprotéase ou exoprotéase selon le pH du milieu.
Elles hydrolysent les liaisons peptidiques, de préférence au niveau des acides aminés chargés positivement, ce qui explique leur faible activité sur les protéines du blé dans lesquelles les acides aminés basiques sont en faible proportion.
Il semble exister d'autres types de protéases, protéases "acide" et protéases "sérine" (STAUFFER, 1987a).
En raison de la diversité des protéases et de la complexité de la structure des protéines de la pâte, les conséquences technologiques de l'activité de ces enzymes demeurent en grande partie méconnues et il est impossible d'expliquer biochimiquement les résultats globaux observés.
Leur utilisation en panification ne peut se faire qu'avec la plus grande prudence parce qu'il est difficile de maîtriser leur action.
L'effet de l'addition de protéases sur la rhéologie des pâtes s'apparente à celui de réducteurs bien que le mode d'action soit différent. La protéolyse diminue la consistance de la pâte, augmente la rapidité d'adsorption d'eau et nécessite une réduction de la durée du pétrissage afin d'éviter une diminution excessive de la viscoélasticité de la pâte. De telles modifications, d'ampleur limitée, peuvent être recherchées en boulangerie pour des farines fortes mais aussi en biscuiterie (DRAPRON et GODON, 1987).
Une activité protéolytique peut être bénéfique pour la qualité sensorielle du produit fini : les acides aminés et peptides formés interviennent comme précurseurs d'arômes et de saveur, soit directement, soit après leur métabolisme par la levure , soit encore après leur transformation par les réactions de Maillard et de caramélisation (ADRIAN et al., 1980).
En raison de leur rôle non négligeable en panification, nous nous limiterons aux phytases et aux lipases.
Les phytases (EC 3.1.3.26) catalysent l'hydrolyse des phytates, ou inositol hexaphosphate, en inositol et phosphates. La phytase est une enzyme relativement thermorésistante puisqu'elle demeure active jusqu'à 70 °C et son pH optimal se situe vers 5. Son activité dépend en conséquence des modes de fermentation panaire : pH et température de la pâte, durée de la fermentation.
La panification sur levain est donc favorable à l'hydrolyse des phytates, de même que toute acidification artificielle de la pâte ; en revanche, le recours à des poudres levantes inhibe l'action des phytases.
L'action des phytases est bénéfique sur le plan nutritionnel car le pouvoir déminéralisant des phytates — résultant de la formation de complexes entre les phytates et les cations minéraux divalents au cours de la digestion —s'en trouve diminué (ADRIAN, 1994).
Les lipases (EC 3.1.1.3) ont la propriété spécifique d'hydrolyser les triacylglycérols à une interface eau-lipide. Chaque lipase présente une spécificité de position. Dans le cas du blé, la lipase libère en premier lieu les acides gras en position 1 et 3.
Lors de la conservation de la farine, les lipases sont les seules hydrolases dont l'activité n'est pas négligeable, cela provient du fait qu'elle n'est pas totalement inhibée par l'absence d'eau solvante (DRAPRON, 1985).
Il en résulte une augmentation de la teneur en Acides Gras Non Estérifiés (AGNE), acide linoléique en particulier ; l'oxydation de ce dernier par auto-oxydation ou par la lipoxygénase conduit à la maturation de la farine puis à son rancissement (NICOLAS, 1979).
Au cours des phases de pétrissage et de fermentation, l'activité de la lipase est très faible sinon nulle.
Il existe dans la farine de blé une phospholipase D (EC 3.1.4.4) hydrolysant la liaison ester acide phosphorique-alcool (ACKER, 1995).
Cette enzyme ainsi que d'autres phospholipases — celles de type A notamment — sont susceptibles de modifier les propriétés tensioactives des phospholipides en intervenant sur leurs interactions avec les autres constituants du milieu : gluten, amidon et phase gazeuse des alvéoles du pâton (KWEON et al.,1994).
CONCLUSIONS
Les connaissances en enzymologie de la panification sont en progression constante. En raison de leurs effets technologiques bien caractérisés, les amylases ont été étudiées de façon approfondie et leurs modalités d'action ont été précisées.
D'autres hydrolases, telles que les protéases et les estérases, ont fait l'objet d'un nombre plus restreint d'études, ce qui ne signifie pas que leurs rôles technologiques soient moins importants.
Par ailleurs, l'obtention d'une pâte de qualité optimale suppose la maîtrise de l'action de ces enzymes par la connaissance, non seulement de certaines activités essentielles mais aussi des teneurs en substrats correspondants.
Il faut également prendre en compte l'influence de certains effecteurs physico-chimiques tels que l'Aw, la température, le pH, et les conditions de pétrissage.
En outre, la possibilité de fabriquer des souches de levure de boulangerie modifiées génétiquement par l'incorporation des gènes codant pour l'a amylase de blé ou d'autres enzymes encore risque de modifier profondément les habitudes industrielles à condition que de telles souches de levure soient non seulement capables de synthétiser ces enzymes mais aussi de les excréter dans la pâte.
Merci a Jacques POTUS , Véronique AMEILLE,
Nadia KAÏD, et Francine EL AMRANI pour ce dossier
"Industries et céréales Jan-fev-mars 1996"









