Autant une fermentation va apporter une « prise de force », autant elle peut la détruire, si on va trop loin en durée (ou maturation) de la pâte. Le gluten dans son élasticité va se détériorer assez vite 80 , surtout si l’on active la fermentation, soit à cause de trop forte doses d’ensemencement de ferment, soit avec des températures trop chaudes 81 .
En fermentation levurée, du fait de l’ensemencement concentré en microorganismes (voir chapitre ; Fermentation ) que l’on ajoute à la pâte, on peut très vite accélérer la maturation de celle-ci qui s’embriquent dans un processus ininterrompu de dégradation des éléments de la pâte.
Si la dégradation au départ est utile pour la prise de force, elle devient destructrice en se poursuivant trop loin. Que se passe-t-il ? Il est simple de comprendre que la levée de la pâte qui est une oxydation va « étirer » le ressort jusqu’à ce qu’il casse.
On peut aussi l’expliquer par un exemple vécu dans la technique para-boulangère. Dès le début des années 1990, la proposition commerciale d’utilisation de levures désactivées 82 est là pour lutter contre l’excédent de force 83 , mais aussi pour pallier à la rapidité du travail (rétrécissement des espaces fermentation et suppression des temps de « détente » de la pâte).
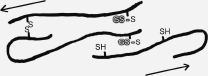
Qu’est la levure désactivée si ce n’est qu’une levure morte qui laisse passer à travers ces membranes des ions - GS – (de la figure 5 ), appelé le glutathion.
Cette matière ira notamment se fixer sur les ions de souffre des molécules d’acides aminés et cassera le « pont dissulfure » (voir : Figure 4).
FIGURE 5 : Le glutathion -GS- de la levure désactivée va insérer une atome H entre les 2 atomes de souffre et fait « sauter » le pont dissulfure.
Si la fermentation levurée du fait qu’elle est exogène (apporté par ajout exterieur) permet de mathématiser ses diagrammes, la fermentation spontanée d’un levain naturel se soumet plus aux aléas de l’environnement. Par la baisse de l’acidité ou mieux dit scientifiquement du pH (= pouvoir d’Hydrogène), l’activité de l’enzyme dégradant les protéines (l’aspartyl-protéase) se trouvant dans la farine, sera plus forte 84 .
En plus les bactéries lactiques ( microorganismes du levain) produisent leurs propres protéases 85 .
Ces deux actions de dégradation vont faire perdre au gluten son élasticité allant jusqu’à la liquéfaction 86 .
Et c’est vrai que le praticien qui va trop loin en fermentation levain voit son pâton perdre toute sa plasticité. Ainsi les protéines du gluten se transformeront en acides aminés du gluten, soit perdre leur fonction technique mais gardé et même bonifier leur fonction nutritive.
Mais comme nous le disions cela n’est pas forcément intéressant pour le boulanger dans la panification.
80 Y.POPINEAU, p. 139 écrit « Les gros peptides résistent à l’hydrolyse ».p.142 « La région la plus sensible aux coupures est la jonction des segments répétitifs », « …lorsque les gliadines sont dénaturée (réduction des ponts dissulfures) , l’hydrolyse est plus rapide. »
81 Piet SLUIMER , p.28 écrit « Une augmentation de 1°C de la température de la pâte entraîne une augmentation de vitesse de développement de 10 à 15%. Souvent les boulangers ne tiennent pas suffisamment compte de cette différence. A 33°C, on constate une diminution significative de la qualité du pain due au fait que la pâte retient moins bien le gaz carbonique pendant la cuisson. ». Toujours plus technique et analyste reprenons Y.DACOSTA, p.18, qui écrit « la solubilité des protéines augmente avec la température »
82 Voir les articles de deux ingénieurs de Lessafre ; P. BONNARDEL et Arnaud DENIAU,.
83 P.BONNARDEL, p. 32 décrit « L’évolution des techniques de panification…mécanisation poussée…et apparition des techniques de cuisson différée » (exemple : le cru surgelé). Puis après il signale que « l’accroissement de la prise de force nécessaire pour répondre à ces évolutions techniques à considérablement modifié la nature des pâtes. Mais l’excès de force peut devenir un défaut. » La critique sur l’excès de force concernait les pâtes pour baguettes, pizzas et le rétrécissement à l’allongement et l’abaisse des pâtons.
84 Une enzyme est plus ou moins active suivant les température et le niveau d’acidité du milieu ou elle vit. On définit ainsi des optimums d’activité pour chaque enzyme. Ici le pH 4 est l’optimum d’activité de la protéase de la farine. Ce pH est aussi le pH du levain. L’enzyme protéase de la farine aurait une activité très limitée en absence de germination, dixit Y.POPINEAU, p. 145.
85 Bernard ONNO, p. 308 & 309. Ces auteurs signalent que le sel peut être inhibiteur des protéases, mais à raison de 3% /kg. farine, ce qui est rarement la dose d’une pâte à pain qui est souvent autour de 2%.
86 N’oublions pas que le vieux classement des protéines s’établissait suivant les solubilités et que les protéines du gluten sont solubles dans des solutions acides et basiques.









