1. Les enzymes ! Ce n’est pas des organismes vivants mais c’est codé par les organismes vivants
Les enzymes, ce n’est pas des organismes ou même des microorganismes vivants.
Mais ils sont codés (ou commandés) par des organismes ou microorganismes vivants.
Les enzymes les plus connus sont peut-être ceux de la digestion. Ils sont nécessaires à toute vie, celle de l’humain, celle de la plante et celle du microorganisme.
Les enzymes peuvent dans le cas précis de la panification provenir de deux sources différentes.
• D’abord, la plante ici prenons l’exemple du blé dont la graine va devoir redonner un épis porteur d’autres graines
• Cette graine devra germer, dans un premier temps, elle va coder tous les enzymes nécessaire à son évolution.
• La deuxième source d’enzymes viendra des microorganismes qui vont créer la fermentation.
• En langage biochimique, on appelle cela, la dégradation enzymatique.
• Et on peut facilement imager qu’une pâte se dégrade.

2. Ils organisent la nécessaire dégradation pour l’assimilation
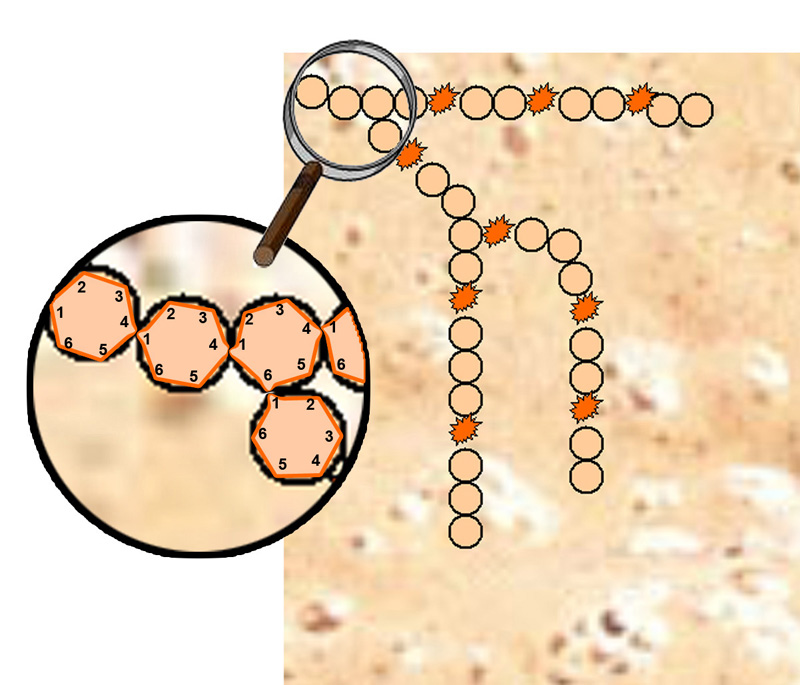
En grossissement on voit les molécules de glucose où l’on représente à l’intérieur un hexagone,
pour figurer qu’à chaque angle se présente un atome de carbone.
Six atomes de carbone = un hexose, cinq atomes de carbone = un pentose,
un pentose = la terminaison des hydrates de carbone en termes bio-chimiques ou sucres en termes populaires.
Les molécules d’hexose que sont les molécules de glucose
sont liées entre-elles de la même manière lorsqu’elles sont en lignes.
C’est l’atome de carbone 1 qui est attaché à l’atome de carbone 4.
Quand les chaînes d’amidon comporte des ramifications,
la liaison de ces chaînes d’amidon
(appelées amylopectine qui représente ± 70 à 80% de l’amidon),
et de ces molécules de glucose se réalisent
entre l’atome de carbone 1 et l’atome de carbone 6.
Pour couper ou dégrader ce dernier type de liaison, il faudra un autre enzyme que l’amylase de la farine
qui n’est pas capable de le réaliser cette «coupure».
On le voit, les enzymes qui portent le nom d’amylases ne sont toujours pas les mêmes.
La science a repéré et affiné toujours plus, ce qu’au début du XXème siècle, elle appelait «diatases».
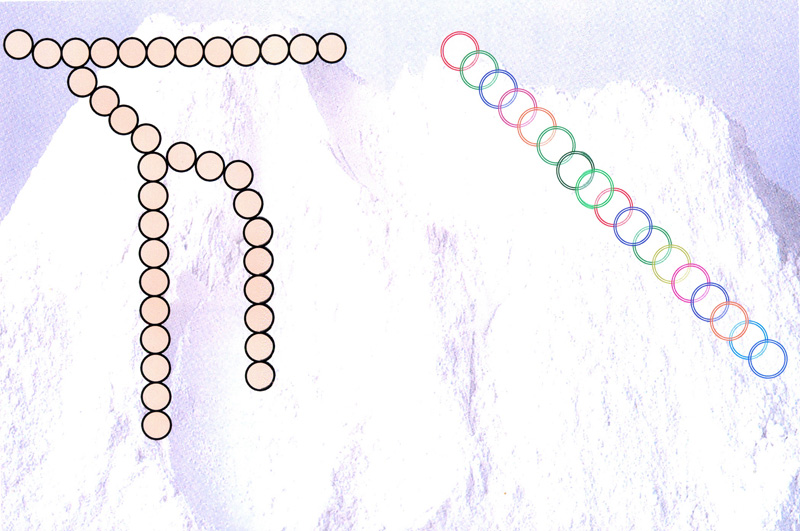
Avec l’hydratation de la pâte, les conditions pour activer les enzymes sont là.
Les enzymes commencent dès lors à couper les chaînes précitées et procurent des bouts d’amidon appelés «dextrines»
et des morceaux de protéines appelés «peptides»
La dégradation enzymatique s’active toujours plus
On peut arriver jusqu’à rendre un aspect apuré (suintant) de la pâte
par la dégradation de l’amidon en nombreuses dextrines,
voire même de sucres simples (une seule molécule de glucose ou deux molécules de glucose soudées appelées maltose).
La dégradation des protéines et peptides va jusqu’à détruire le «nerf de la pâte»
formé de chaînes de protéines appelées gluten.
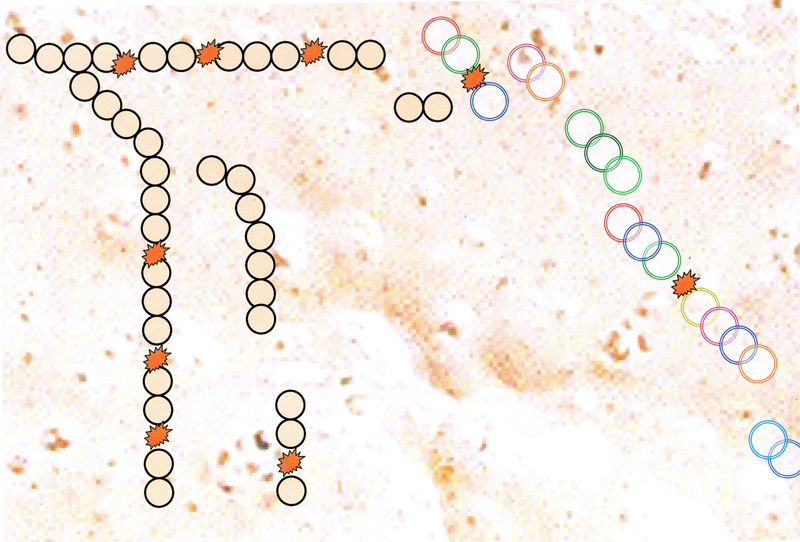
3.Chaque enzymes est différent.
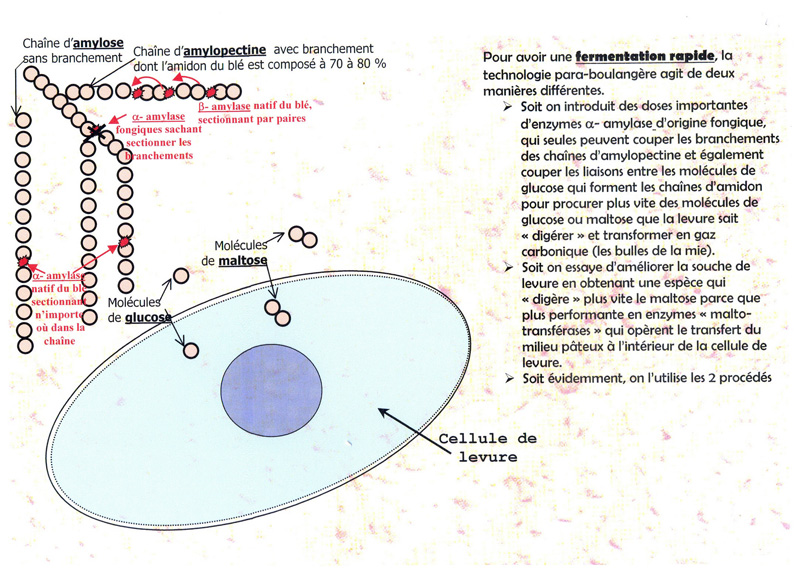
4.L'enjeu des firmes para-boulangères, la fermentation rapide
Comme dans la farine seul +/- 1 % des hydrates de carbones sont des sucres simples
(en une seule molécule de glucose ou en deux molécules = maltose)
qui sont aussi les seuls pouvant être assimillé par les levures,
il faut dégrader plus vite l'amidon pour procurer de nouvelles molécules de glucose et maltose
afin que la levure puisse produire du gaz carbonique (CO) et fasse suffisament
et surtout rapidement levé la pâte à pain.
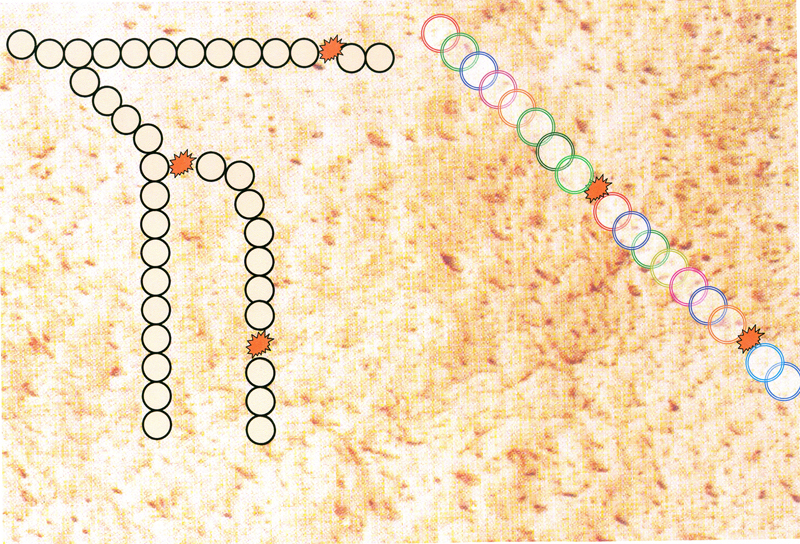
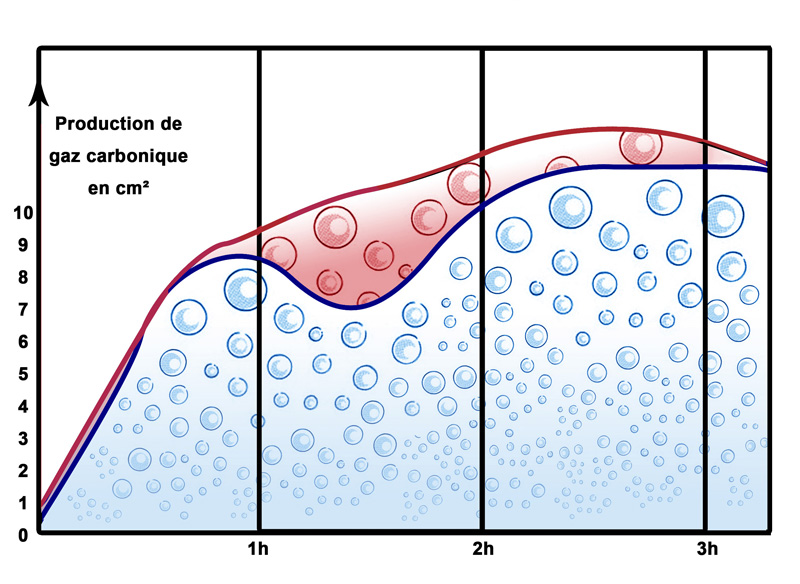
Vers les années 1970, les souches de levure employées (en bleu dans le schéma)
devaient attendre l’arrivée de sucres simples (glucose en une seule molécule) dégradés de l’amidon par les amylases.
Arrivé à 1 h. de fermentation, celle-ci stoppait en production de gaz (CO) pour reprendre vers 2h. de fermentation.
On a alors choisi une souche de levure qui savait mieux transformé le maltose en CO.
Cette souche (en rouge dans le schéma) sera dite alors levure rapide.
5. La zymase n’est plus ce qu ‘elle était.
Vers 1930, au temps où les enzymes étaient souvent baptisés de noms avec des terminaisons en «…ine»,
on n’était informé que sur 80 enzymes.
En 1947, 200 enzymes sont connus, 850 enzymes sont renseignés en 1968 et 2.500 dénombrés en 1984.
Aujourd’hui, où la terminaison en «…ase» est ajouté au nom du substrat qu’il transforme,
il faudrait employé un spécialiste à temps plein pour en connaître le nombre.

6. Le principe d’action des transformations enzymatiques
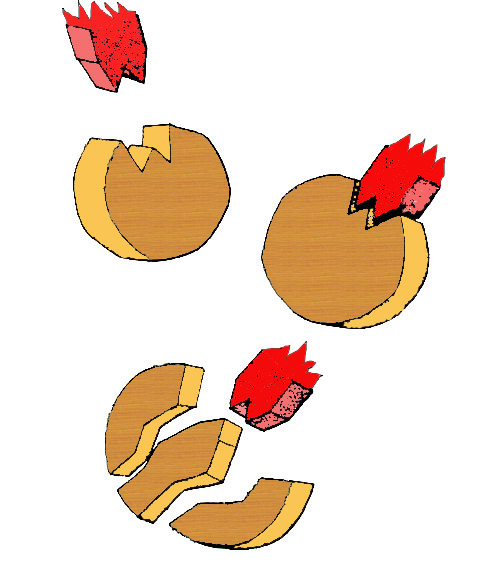
La théorie d’Emil Fischer (fin du XIXème siècle) du modèle «clef et serrure» est repris pour expliquer schématiquement
que le substrat, ici la molécule de glucose par exemple, sera la serrure et l’enzyme la clef.
Le substrat (la serrure) ne pourra se dégrader que si le panneton correspond exactement à la clef (l’enzyme),
avec un seul mode de clef, elle ne peut tourner que d’un côté à l’exclusion de toute autre manœuvre .
Ce qui s’appelle catalyse, lorsque l’action dissout ou dégrade et (plus rarement) anabolyse lorsqu’elle assemble ou synthétise.
De nos jours sur Internet, de très belles animations (avec effet flash)
permettent d’expliquer cette action enzymatique vu par l’image de la clef et de la serrure.
Nous avons aimé > celle-ci...
Nécessaire à une bonne action enzymatique, les co-enzymes (en bleu sur le schéma de droite)
seront nécessaire à l’emboitement de la clef dans la serrure.
Ces co-enzymes peuvent être des vitamines ou des éléments minéraux, le phosphore et le calcium sont important
pour la glycolyse (du grec :glycos= sucré & lysis= scission) .
Ainsi si une farine complète souvent 2 à 3 fois plus riches en minéraux et 3 à 5 fois plus riches en vitamines
sera plus activable enzymatiquement, d’autant que contrairement aux enzymes les co-enzymes doivent se régénérer.
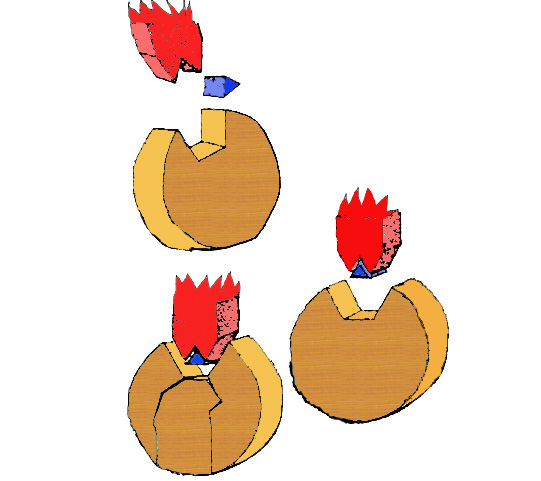
Des protéines du blé et certains métaux lourds peuvent agir comme inhibiteur d’enzymes.
Comme le montre le schéma, l’inhibiteur (en vert) empêche la clef d’aller dans la serrure en se plaçant entre eux.

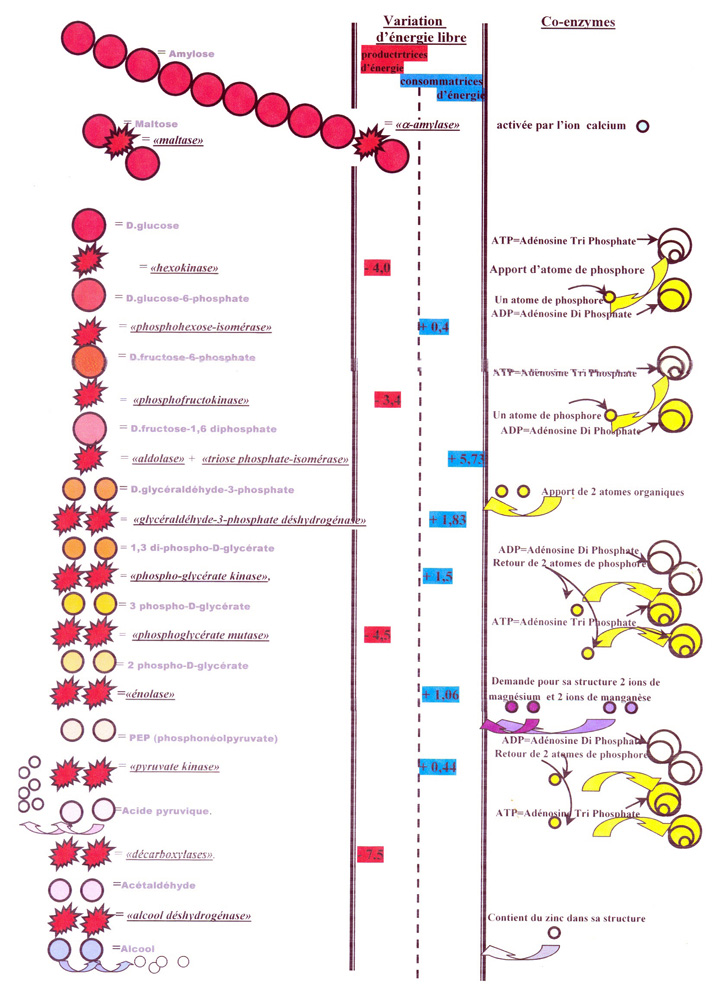
7.Les transformations enzymatiques et les apports & demandes d’énergie & le rôle des co-enzymes dans la dégradation du glucose
Pour transformer la molécule de glucose en CO (glycolyse),
les transformations enzymatiques ont besoin d’énergie transmise par l’apport de mo ?lécule de phosphore.
Ce qui est beau comme constat, c’est que dans la première partie de la glycolyse,
elle consomme 2 molécules de phosphore de l’ATP
pour en rendre 4 aux molécules d'ADP lors de la deuxième partie
et ainsi permettre de doubler la même opération de transformation du glucose après.
C'est beau de voir comment la nature est pensée.
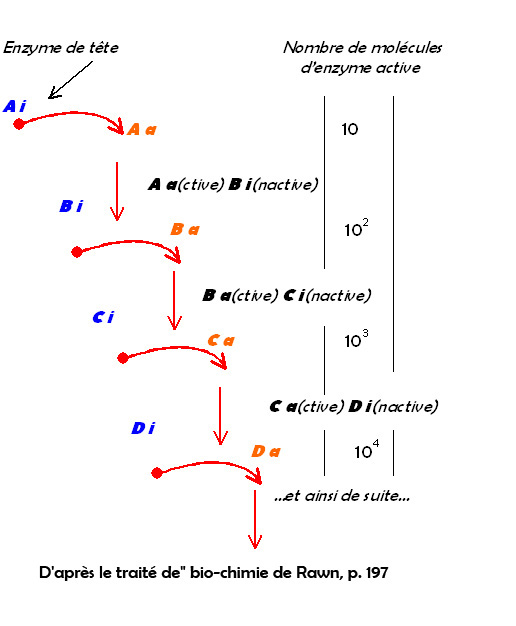
8. Les cascades enzymatiques ou voies fermentaires

9. Les différentes activités enzymatiques suivant la température et l’acidité
L’activité de chaque types d’ enzymes varie en fonction de l’acidité du milieu.
Elle décroît avant et après ce point optimum d’activité
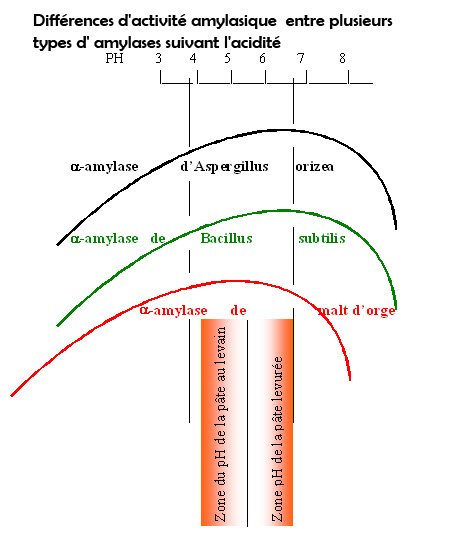
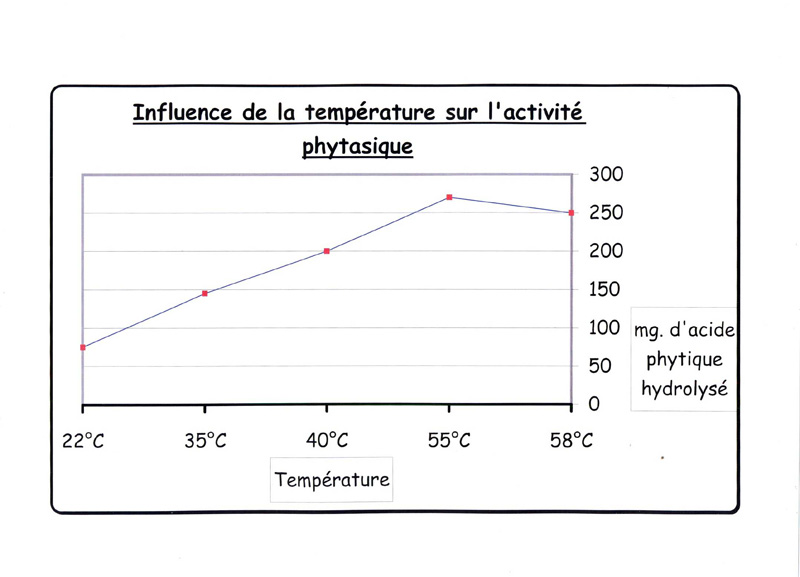
C’est également vrai pour les températures, les enzymes ont leur zone d’activité plus intense
qui s’affaiblit dès que l’on s’éloigne de ce stade où l’efficacité est à son maximum .
Exemple avec l’influence de la température sur l'enzyme phytase.
10. Une année n’est l’autre, la correction enzymatique de la récolte
On l’oublie trop souvent le blé comme le raisin est soumis au climat chaque année différent pendant la période de sa récolte.
Si en plus, lors de la moisson, un blé a été récolté humide ou déjà germé sur pied,
il risque de ne pas permettre de se faire classer comme panifiable.
Le terme de l’instrument qui mesure cet accident climatique sur la farine de blé est dit «indice (ou temps ou taux) de chute»,
puis est suivi du nom de l’inventeur Hagberg
Sur la toile, un diaporama explique bien le procédé à cette adresse.
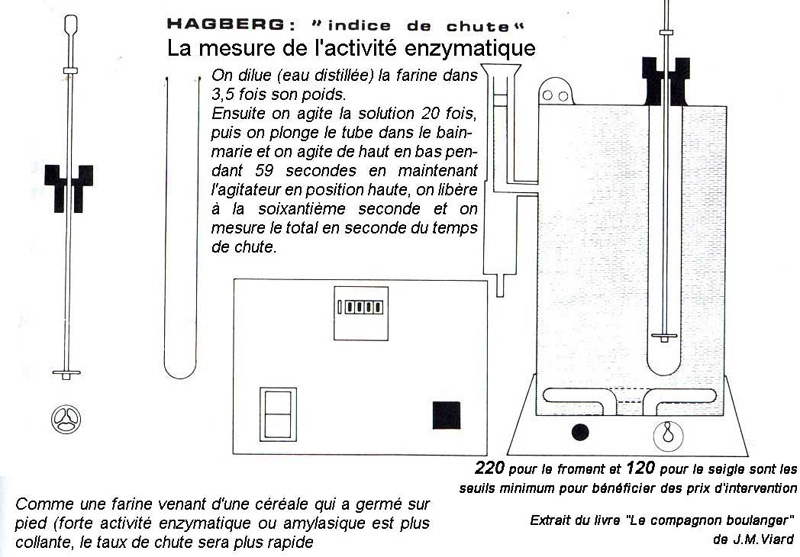
Dès le moment où le germe pointe et a par conséquent casser la protection
que procure l’enveloppe du grain contre l’humidité et les insectes.
La farine qui en est issu risque fort d’être déclassée en termes de trop forte activité enzymatique (dite aussi diastasique),
elles seront «pesante et lourde» comme peut déjà l’apercevoir
en comparant la farine de seigle par rapport à la farine de blé (froment).
Cet accident est plus connu au Nord (région plus pluvieuse) qu’au Sud de l’Europe.
Dans ces dernières contrées, le climat sec risque lui de procurer des farines qui n’ont pas assez d’activité amylasique.
Il faut alors ajouter des farines de malt (à forte activité amylasique) ou des amylases (issu de l’industrie et souvent produit par des moisi ?ssures –amylases fongiques-)
par des microorganismes génétiquement modifié.
Ou le meuniers mélange une farine hypodiastasique (trop d’activité enzymatique) avec une farine hyperdiastasique (trop d’activité enzymatique).
C’est le seul moyen d’utiliser ces farines issus de blés trop riche en enzymes.










